
GAYA VAN DER WAALS YouTube
Pembahasan. Johannes Diderik Van der Waals berpendapat bahwa molekul-molekul dalam suatu zat tidak saling tolak menolak karena diantara molekul-molekul tersebut terdapat suatu gaya tarik menarik yang lemah. Gaya tarik menarik yang lemah ini disebut gaya Van der Waals.

Apa Yang Dimaksud Dengan Gaya Van Der Waals Ujian
Gaya van der Waals dalam ilmu kimia merujuk pada jenis gaya antara molekul. Istilah ini pada awalnya merujuk pada jenis gaya antarmolekul, dan hingga saat ini masih digunakan dalam pengertian tersebut, tetapi saat ini lebih umum merujuk pada gaya-gaya yang timbul dari polarisasi molekul menjadi dipol.. Hal ini mencakup gaya yang timbul dari dipol tetap (gaya Keesom), dipol rotasi atau bebas.

Apa Yang Dimaksud Dengan Gaya Van Der Waals Ujian
Gaya Antarmolekul : Gaya Van der Waals dan Ikatan Hidrogen Ikatan hidrogen adalah ikatan yang terbentuk akibat gaya antar molekul polar yang memiliki ikatan antara H dengan atom-atom yang sangat elektronegatif seperi N, O, atau F. Contoh: air (H 2 O), asam fluorida (HF), amonia (NH 3).. Ikatan hidrogen mengakibatkan penyimpangan tren periodik titik didih senyawa golongan VA-VIIA menjadi sangat.

Van der Waals bonding
2. Gaya van der Waals. Gaya van der Waals adalah gaya tarik antar molekul dalam suatu molekul kovalen yang dapat disebabkan oleh tiga hal, yaitu dipol-dipol, ion-dipol, dan dipol sesaat (Gaya London). Dipol-Dipol adalah gaya tarik menarik antara molekul polar dengan molekul polar. Contohnya, interaksi antar molekul HCl.

Apa Yang Dimaksud Dengan Gaya Van Der Waals Ujian
Gaya van der Waals dalam ilmu kimia merujuk pada jenis gaya antara molekul. [1] Istilah ini pada awalnya merujuk pada jenis gaya antarmolekul, dan hingga saat ini masih digunakan dalam pengertian tersebut, tetapi saat ini lebih umum merujuk pada gaya-gaya yang timbul dari polarisasi molekul menjadi dipol.. Hal ini mencakup gaya yang timbul dari dipol tetap (gaya Keesom), dipol rotasi atau.

Apa Yang Dimaksud Dengan Gaya Van Der Waals Ujian
Kekuatan gaya tarik antar-molekul mampu menentukan apa yang akan terjadi. Gaya antar-molekul terbagi menjadi tiga macam, yakni gaya Van der Waals, ikatan hidrogen, dan gaya london. Contoh Gaya Antar-Molekul 1. Gaya Van der Waals Sesuai namanya, gaya Van der Waals pertama kali ditemukan oleh Johannes Van der Waals (1837—1923).

Pada gambar berikut ini, ikatan van der Waals gaya dipol...
Antar aksi dipol terinduksi-dipol terinduksi (gaya london) Gaya van der Waals bersifat permanen sehingga lebih kuat dari gaya london. Gaya van der Waals terdapat pada senyawa hidrokarbon seperti CH 4. Perbedaan keelektronegatifan C(2,5) dengan H(2,1) sangat kecil, yaitu 0,4.
/91560215-56a133565f9b58b7d0bcfb65.jpg)
Apa Yang Dimaksud Dengan Gaya Van Der Waals Ujian
KOMPAS.com - Gaya antarmolekul adalah gaya yang terjadi di antara atom-atom sehingga dapat membentuk molekul ataupun senyawa tertentu.. Gaya antarmolekul terdiri dari gaya London atau dipol-dipol, gaya Van der Waals, dan ikatan hidrogen.Simak penjelasannya seperti dikutip dari Encyclopaedia Britannica:. Gaya London. Gaya london adalah gaya tarik menarik antaratom karena adanya dipol sesaat.

Gaya Van Der Waals PDF
BAB III KESIMPULAN f1. Gaya Van Der Waals merupakan gaya tarik-menarik antara atom atau molekul, dimana gaya ini relatif jauh lebih lemah dibandingkan gaya yang timbul karena ikatan valensi 2. Sifat-sifat gaya Van Der Waals tersusun dari beberapa gaya tarik antar molekul, yaitu : Gaya Orientasi Gaya Induksi Gaya Dispersi 3. Ada tiga hal yang.

Ikatan Kimia Kelas 10 • Part 15 Gaya Antar Molekul Ikatan Hidrogen & van der Waals, Gaya
Contoh Gaya Antar Molekul. Berdasarkan catatan Nana Sutresna dalam Cerdas Belajar Kimia (2007:30), diungkap ada lebih dari satu jenis kategori gaya antar molekul, mulai dari gaya akibat "ikatan hidrogen" hingga "gaya london dan van der Waals". Berikut penjelasan mengenai dua subbab bahasan tersebut: 1. Ikatan Hidrogen.

Gaya Antar Molekul ( Gaya Van der Waals ) YouTube
Van der Waals, yaitu gaya orientasi, gaya imbas, dan gaya dispersi. a. Gaya orientasi/Gaya dipol-dipol Gaya orientasi terjadi pada molekul-molekul yang mempunyai dipol permanen atau molekul polar. Antar aksi antara kutub positif dari satu molekul dengan kutub negatif dari molekul yang lain akan menimbulkan gaya tarik menarik yang relatif lemah.

Pembahasan 10 Soal (PG) Gaya Antarmolekul Van der Waals‼️ Lengkap YouTube
Gaya London lebih lemah dibandingkan dengan gaya Van der Waals. Bisa dikatakan juga bahwa gaya ini adalah yang terlemah dibandingkan dengan gaya lainnya. Gaya ini pertama kali ditemukan oleh ahli fisika asal Jerman bernama Fritz London pada 1930. Tarikan lemah yang dihasilkan oleh gaya London karena dipol imbasan sesaat yang terjadi akibat.

Apa yang Dimaksud dengan Gaya van der Waals? Mengapa Penting untuk Mempelajari Gaya Ini? 2023
Sumber: van der Waals forces. Gaya Van der Waals atau disebut juga gaya dipol-dipol adalah gaya yang terjadi di antara molekul-molekul yang memiliki sebaran muatan tidak homogen, yaitu molekul-molekul dipol atau molekul polar. Gaya yang berasal dari gaya elektrostatik ini diusulkan pertama kalinya oleh Johannes Van der Waals (1837-1923).
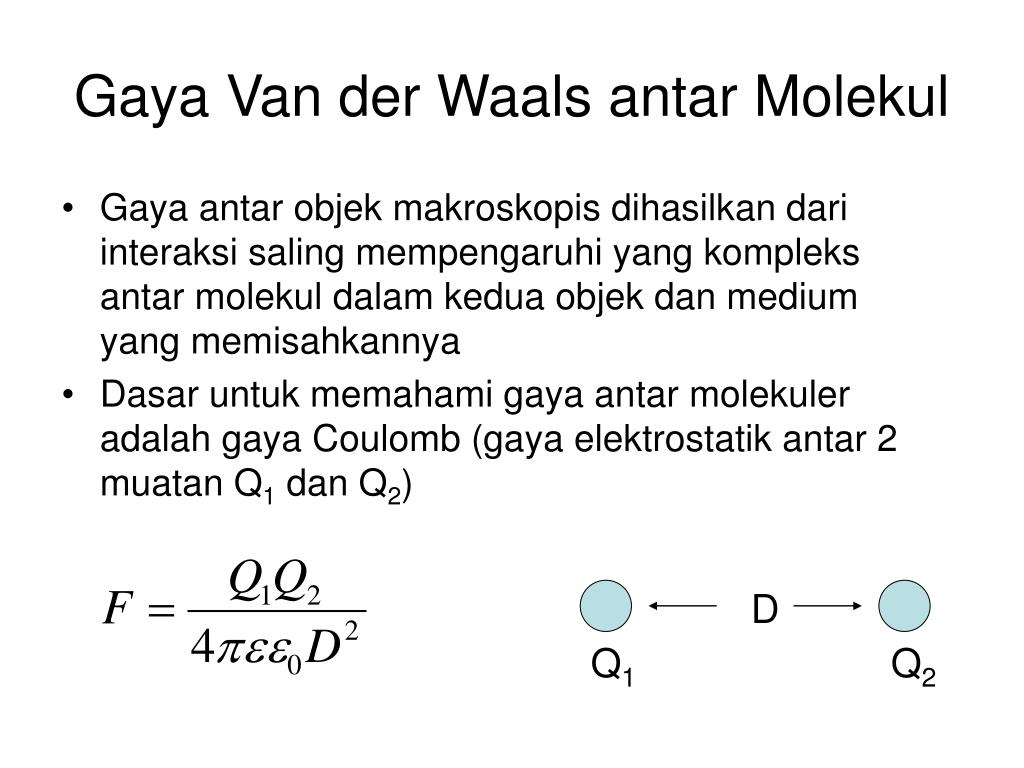
PPT SURFACE FORCES PowerPoint Presentation, free download ID4032776
Gaya dispersi juga dianggap sebagai jenis dari gaya Van Der waals yang mana gaya ini merupakan gaya yang paling lemah dari semua gaya yang ada antar molekul. Mereka sering juga disebut dengan gaya london sesudah Fritz London ( 1900- 1954 ), untuk pertama kali mengajukan keberadaan mereka pada tahun 1930 an.

SINTESIS KIMIA ORGANIK GAYA VAN DER WAALS
Gaya yang terjadi antara molekul HCl dengan molekul HCl lain disebut gaya Van der Waals atau gaya antar molekul. Untuk memahaminya, simaklah penjelasan di bawah ini! Hidrogen klorida (HCl) adalah seyawa polar yang memiliki dipol- dipol permanen. Dilansir dari Chemistry Learner, dipol HCl terbentuk dari atom hidrogen (H) yang bermuatan parsial.
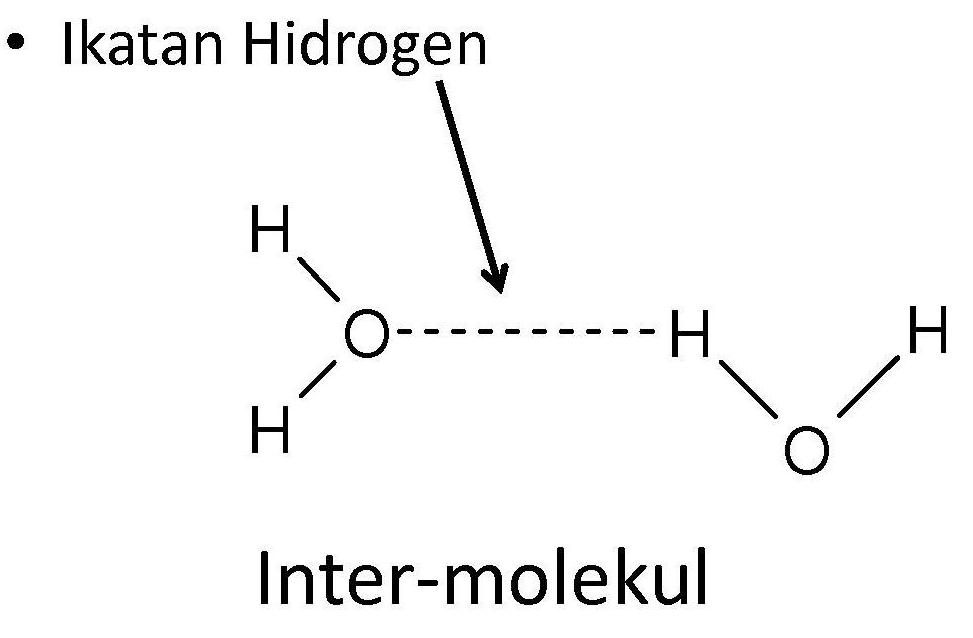
SINTESIS KIMIA ORGANIK GAYA VAN DER WAALS
Komponen Gaya Van der Waals. Gaya Van der Waals adalah gaya antarmolekul yang paling lemah . Kekuatan mereka biasanya berkisar dari 0,4 kilojoule per mol (kJ/mol) hingga 4 kJ/mol dan bekerja pada jarak kurang dari 0,6 nanometer (nm). Ketika jaraknya kurang dari 0,4 nm, efek bersih dari gaya-gaya tersebut adalah tolak-menolak karena awan.