
Menghitung Jumlah mol jika diketahui Massa Molar Zat dan Massa Molekul Relatif YouTube
Penjumlahan ini menentukan massa molar untuk keseluruhan senyawa. Ambillah hasil perkalian yang Anda dapatkan dari langkah selanjutnya dan jumlahkan hasil perkaliannya untuk menghitung massa molar senyawa. Untuk hidrogen klorida, massa molarnya adalah 1,007 + 35,453 = 36,460 g/mol. Massa satu mol hidrogen klorida adalah 36,46 gram.

Menentukan Mol Zat yang lain Jika diketahui Salah Satu Mol Zat Dalam Persamaan Reaksi YouTube
Contoh Soal Konsep Mol Beserta Jawabannya. 1. Sebanyak 4,9 gram H2SO4 H 2 SO 4 dilarutkan dalam air sehingga diperoleh 500 mL larutan. Tentukan jumlah ion yang yang terlarut dalam larutan dan tentukan konsentrasi ion H+ H +. Jawaban contoh soal konsep mol dan penyelesaiannya. nH2SO4 = m Mr = 4, 9 98 = 0, 05 mol n H 2 SO 4 = m M r = 4, 9 98 = 0.

Fraksi Mol Dan Molalitas M Soal Dan Pembahasan Kimia Kelas 12 Riset
Cara Menghitung Pecahan Mol Suatu Larutan. Fraksi mol atau fraksi mol adalah jumlah mol dari satu komponen larutan dibagi dengan jumlah mol semua spesies kimia. Jumlah semua fraksi mol berjumlah 1. Perhatikan bahwa mol saling hapus saat menghitung fraksi mol, jadi ini adalah nilai tanpa satuan.
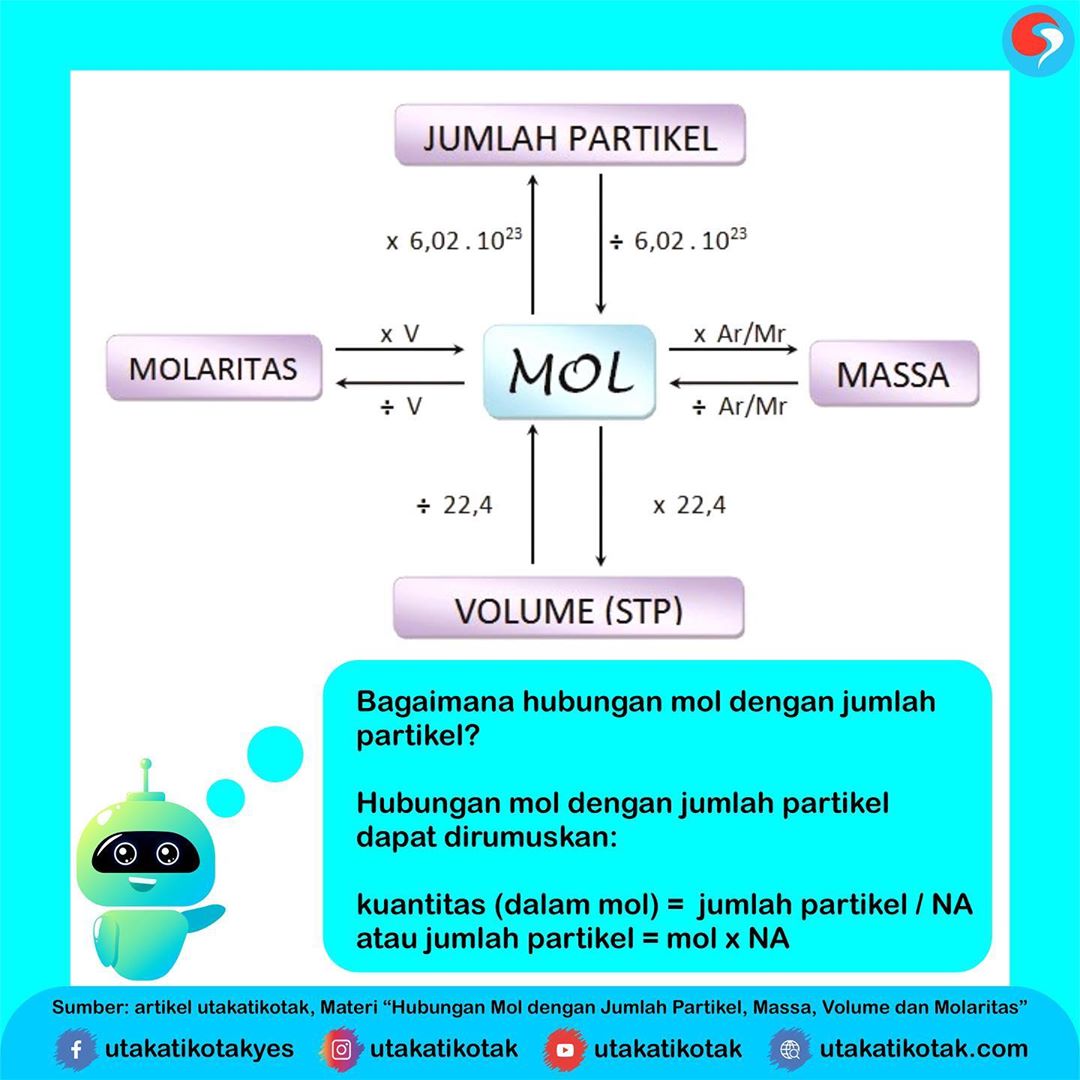
Hubungan Mol dengan Jumlah Partikel, Massa, Vo
Untuk melakukannya, Anda dapat mencari perbandingan mol yang paling kecil. Anda dapat menggunakan perbandingan mol terkecil karena perhitungan ini membuat unsur yang tidak melimpah bernilai "1" dan menghasilkan perbandingan unsur-unsur lain dalam senyawa. Contoh: Jumlah mol terkecil adalah oksigen dengan 0,53 mol.

Kimia mol pada pereaksi pembatas contoh soal YouTube
Molalitas larutan bisa dihitung dengan cara : Jumlah mol NaOH, n = gram/Mr = 10/40 = 0,25 mol Molalitas larutan, m = n/P = 0,25/2 = 0,125 molal Maka molalitas larutan NaOH yaitu 0,125 molal. Contoh perhitungan normalitas larutan. Misalnya 0,5 liter larutan NaOH dibuat dengan cara melarutkan 5 gram NaOH (Mr = 40) dalam air.
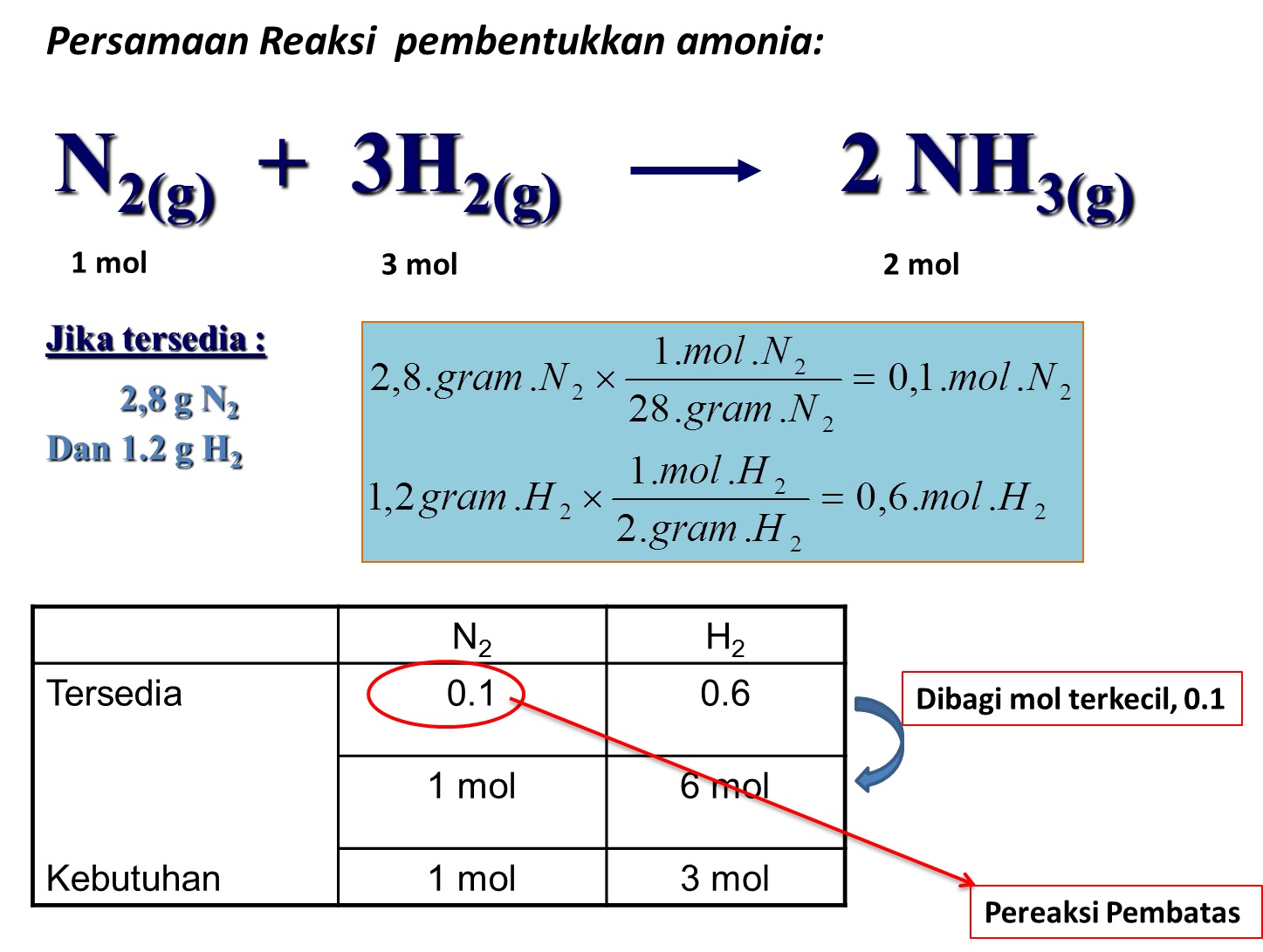
5 Tahapan Yang Harus Kamu Lewati untuk Menentukan Pereaksi Pembatas dalam Reaksi Kimia Materi
Dalam bidang kimia ada beberapa satuan yang sering digunakan untuk menyatakan konsentrasi larutan ( banyaknya zat terlarut dalam sejumlah pelarut ). Beberapa satuan konsentrasi itu antara lain : mol, molalitas, molaritas, normalitas, ppm, persen massa, persen volum. Berikut akan saya jelaskan pengertian dan rumus dari satuan-satuan di atas : 1.

Pengertian Rumus Dan Contoh Soal Mol Molalitas Molaritas Dan Riset My XXX Hot Girl
Ingat, rumus molaritas pencampuran adalah: Maka, konsentrasi larutan setelah dicampurkan adalah: M campuran = (100 x 0,1) + (150 x 0,2) / (100 + 150) = 40 / 250. = 0,16 M. Quipperian, itu dia pembahasan mengenai rumus molaritas beserta contoh soal dan pembahasannya. Agar semakin paham dan mahir dalam menggunakan rumus molaritas, cobalah untuk.

Latihan Soal Konsep Mol YouTube
Seperti soal sebelumnya, kita gunakan terlebih dahulu rumus mol namun terhadap volume gas STP. Selanjutnya kita bisa masukan ke dalam persamaan. Massa senyawa = Mr x Jumlah mol. 4,25 g = Mr x 0,125 mol. Mr = 34. Jadi, diketahui Mr dari 4,25 g gas dengan volume 2,8 L sebesar 34.

Contoh Soal Fraksi Mol Dan Pembahasannya
Contoh soal: gram terlarut * (1/massa molar terlarut) = 3,4 g * (1 mol / 158 g) = 0,0215 mol. 5. Bagilah jumlah mol dengan banyaknya liter. Karena kamu sudah memiliki jumlah mol, kamu bisa membaginya dengan banyaknya liter larutan untuk mencari molaritas. Contoh soal: molaritas = mol terlarut / liter larutan = 0,0215 mol / 5,2 L = 0,004134615. 6.

Rumus Fraksi Mol Pengertian, Sifat dan Contoh Soalnya Lengkap BprsKu.Co.Id
Setelah mempelajari mol & konsep stoikiometri, maka kita telah menguasai dasar-dasar dari salah satu cabang kimia yakni kimia analitik, yang berkutat mengenai jumlah zat dan perubahannya dalam reaksi. Untuk mulai belajar materi & contoh soal Mol & Stoikiometri dan penyelesaiannya kamu bisa langsung klik daftar materi dibawah ini.

Menentukan perbandingan mol senyawa penyusun Buffer pada pH tertentu YouTube
Rumus Mol. Jika kamu diminta untuk menentukan mol dari suatu zat yang diketahui massanya, gunakan persamaan berikut. Dengan: n = mol; m = massa zat; dan. Mr = massa molekul relatif. Langkah-Langkah Menentukan Fraksi Mol. Untuk memudahkanmu dalam menentukan fraksi mol, yuk ikuti langkah berikut.
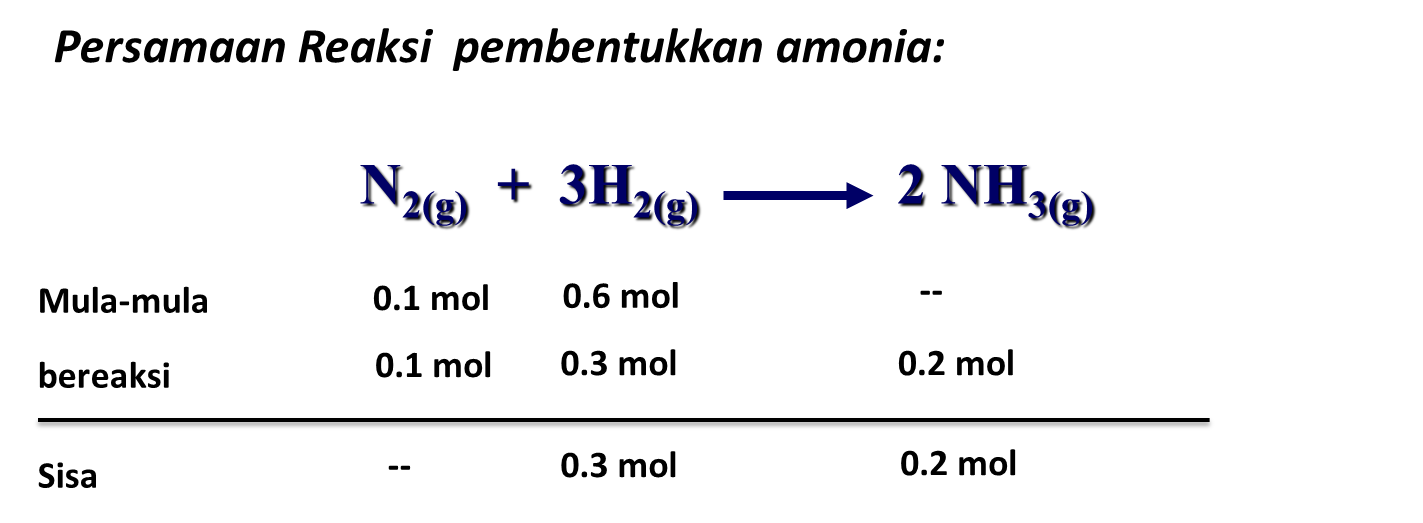
Cara Menentukan Pereaksi Pembatas dan Pereaksi Sisa Materi Kimia
1. Tentukan jumlah partikel H2O dalam 2 gram. Kita tahu bahwa massa molekul H2O adalah sekitar 18 gram per mol. Oleh karena itu, 2 gram H2O setara dengan: 2 gram H2O x (1 mol H2O / 18 gram H2O) = 0,111 mol H2O. 2. Gunakan rumus mol = jumlah partikel / Avogadro's number. Mol = 0,111 mol H2O / (6,02 x 10^23 partikel/mol) = 6,96 x 10^-24 mol.

Konsep Mol dan Analisanya
Nah, rumus molekul ini digolongkan menjadi dua, yaitu rumus molekul unsur dan rumus molekul senyawa. 1. Rumus Molekul Unsur. Rumus molekul unsur adalah rumus yang menyatakan gabungan atom-atom yang sama jenis unsurnya lalu membentuk sebuah molekul. Nah, molekul unsur dibagi lagi menjadi dua berdasar dari jumlah atom yang bergabung.

Kimia 12 Molaritas Molalitas dan Fraksi Mol YouTube
Adapun, mol suatu zat dapat diketahui berdasarkan volume gas yang tidak berada dalam keadaan standar yang diambil dari persamaan gas ideal. Rumus mol berdasarkan volume gas tidak standar adalah: Dengan, P: tekanan gas (N/m² atau Pa) V: volume gas (m³) R: konstanta gas (8,31 J/mol.K)

Konsep Mol Pada Kimia Rezfoods Resep Masakan Indonesia
Rumus empiris suatu molekul dapat ditentukan dengan cara mencari jumlah mol atom dengan massa molar, lalu menentukan rasio perbandingan mol atom-atom penyusun senyawanya. Contoh soal penentuan rumus molekul: Misalkan suatu senyawa dengan massa molekul relatif sebesar 180,18 terdiri atas campuran 60% karbon, 6,72% hidrogen, dan 53,28% oksigen.

Molalitas Adalah Pengertian Dan Perbedaan Dengan Molaritas Dan Rezfoods Resep Masakan Indonesia
Lalu, tentukan jumlah mol C 3 H 8. Menentukan jumlah mol gas CO 2 yang terbentuk. Jadi, jumlah mol gas CO 2 yang terbentuk adalah 1,5 mol. Apakah Quipperian sudah paham tentang konsep mol? Materi ini merupakan materi dasar yang harus Quipperian kuasai di Kelas 10, terlebih lagi jika Quipperian bercita-cita menjadi seorang apoteker atau laboran.