
Kumpulan Contoh Soal Kalorimetri dan Perubahan Entalpi Reaksi Kimia Kelas 11 CoLearn
Contoh Soal Kalorimeter. 1. Sebanyak 2 g naftalena (C10H8), zat yang berbau tajam dan biasa digunakan untuk mengusir ngengat, dibakar dalam kalorimeter bom. Dari hasil pengamatan, suhu air dalam kalorimeter naik sebesar 5°C. Jika kapasitas kalor kalorimeter adalah 10,17 kJ/°C, tentukanlah perubahan entalpi pada reaksi tersebut!.

Contoh Soal Kalorimeter Kimia
Contoh Soal No. 6. Sebanyak 7,5 gram LiOH (Ar Li = 7, O = 16, H = 1) dimasukkan ke dalam kalorimeter yang berisi 120 gram air. Setelah kristal LiOH itu larut, ternyata suhu kalorimeter beserta isinya naik dari 24°C menjadi 35°C. Kalor jenis larutan = 4,2 J/g°C dan kapasitas kalor kalorimeter = 12 J/°C.

CONTOH SOAL KALORIMETER YouTube
Kalorimetri adalah proses pengukuran jumlah kalor reaksi yang diserap atau dilepaskan pada suatu reaksi kimia dalam suatu eksperimen. Data-data perubahan entalpi reaksi yang terdapat pada tabel merupakan hasil perhitungan kalorimetri. Dengan menggunakan kalorimetri kita dapat menentukan apa jenis reaksi yang terjadi, apakah reaksi tersebut.

Contoh Soal Kalorimeter Terlengkap Rangkuman Contoh Soal Termokimia Pembahasan Jawaban / Oleh
Video Contoh Soal Kalorimetri dan Perubahan Entalpi Reaksi Kelas 11. 02:55. Kalorimeter dikalibrasi dengan cara mencampurkan 50 g air. Kalorimetri dan Perubahan Entalpi Reaksi;. Cari soal Matematika, Fisika, Kimia dan tonton video pembahasan biar ngerti materinya. Matematika, Fisika dan Kimia;

Contoh Soal Kalorimeter Beserta Jawabannya Terbaru
Aggar lebih jelas perhatikan contoh soal menentukan perhitungan entalpi dengan kalorimeter berikut ini. Soal No. 1. Dalam suatu eksperimen, didapati 50 mL larutan KOH 1 M pada suhu 30,5 0 C bereaksi dengan 50 mL asam asetat 1 M pada suhu 29,5 0 C. Pada reaksi tersebut suhu campuran menjadi 26,5 0 C. Berdasarkan data tersebut hitung kalor.

Kumpulan Contoh Soal Kalorimetri dan Perubahan Entalpi Reaksi Kimia Kelas 11 CoLearn
Untuk lebih mudah memahami cara kerja kalorimeter bom, perhatikan contoh soal kalorimeter bom berikut ini. Soal No. 1. Suatu kalorimeter bom berisi 250 mL air yang suhunya mencapai 25 0 C, kemudian dibakar 200 mg gas metana. Suhu tertinggi yang dicapai air dalam kalorimeter bom adalah 35 0 C. Jika kapasitas kalor kalorimeter itu = 75 j/ 0 C dan.

Cepat Paham Soal Termokimia Cara Kalorimetri (variasi soal mudah hingga sulit) Part 1 YouTube
Contoh Soal dan Pembahasan. Anis menyiapkan minuman es teh untuk pekerja di rumahnya dalam suatu wadah. Ia mencampur 0,5 kg es yang bersuhu 5 o C dengan 1 kg air teh yang suhunya 20 o C. Apabila pertukaran kalor hanya terjadi pada kedua benda, c es = 2.100 J/kg o C, dan c air = 4.200 J/kg o C,.

KALORIMETRI KALORIMETER Soal dan Pembahasan Kalerimetri PAK BOSS Channel Pintar Kimia
1. Asas Black. Menurut hukum kekekalan energi, bahwa energi tidak dapat diciptakan atau dimusnahkan, yang terjadi hanyalah perubahan bentuk energi yang satu ke bentuk energi yang lain. Kita ambil contoh, sebuah benda A massa m1, suhu T1 dan kalor jenisnya c1. Kemudian kita masukkan ke dalam air B yang massanya m2, suhu T2, dan kalor jenis c2.

KALORIMETER Menghitung Perubahan Entalpi dengan Kalorimetri Kimia kelas XI YouTube
Kalorimetri merupakan merupakan sistem yang dimana tidak ada perpindahan materi dan energi dengan lingkungan di luar kalorimeter tersebut. Kalorimeter ini ada dua jenis, yaitu kalorimeter bom dan sederhana.. Contoh Soal dan Pembahasan. Contoh Soal: Di dalam suatu kalorimeter bom direaksikan 0,16 gram gas metana (CH 4) dengan oksigen berlebih
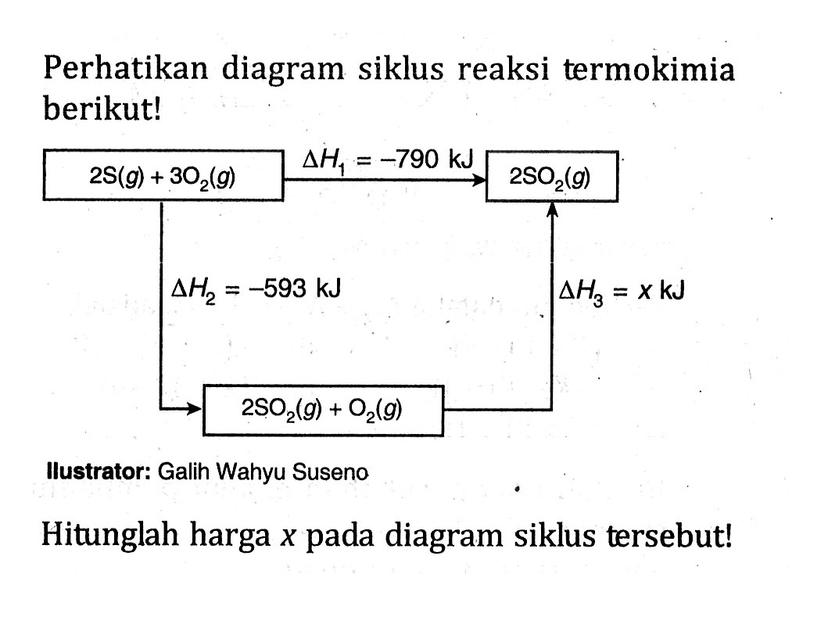
Kumpulan Contoh Soal Kalorimetri dan Perubahan Entalpi Reaksi Kimia Kelas 11 CoLearn
Tinjau aliran panas dan kalorimetri dengan contoh kerja soal kimia ini untuk cangkir kopi dan kalorimeter bom. Menu. Rumah. Sains, Teknologi, Matematika Sains matematika Ilmu Sosial Ilmu Komputer Hewan & Alam Sastra Sejarah & Budaya seni visual literatur Bahasa inggris Geografi Filsafat Masalah

Kumpulan Contoh Soal Kalorimetri dan Perubahan Entalpi Reaksi Kimia Kelas 11 CoLearn
Contoh Soal No. 1. Dalam suatu percobaan penentukan ∆H reaksi dengan menggunakan kalorimeter sederhana, sejumlah 0,05 mol logam nikel dimasukkan ke dalam larutan CuSO 4 .Termometer menunjukkan kenaikan suhu sistem (larutan) sebesar 5 0 C. Jika kapasitas kalor larutan sebesar 4 kJ/ 0 C dan kapasitas kalorimeter dianggap nol (sama sekali tidak.

Soal Dan Pembahasan Kalorimeter
Termokimia: Konsep Dasar, Rumus, Contoh Soal dan Pembahasannya Ilustrasi oleh dribbble.com Daftar Isi + Konsep Dasar Entalpi Termokimia; Persamaan Rumus Termokimia; 2H 2 (g) + O 2 (g) → 2H 2 O(g) ΔH= −483,6 kJ ; a. Kalorimeter bom (kalorimetri volum konstan) b. Kalorimeter sederhana (kalorimetri tekanan konstan) Contoh Soal dan.

MENGHITUNG PERUBAHAN ENTALPI MENGGUNAKAN KALORIMETRI YouTube
Video ini berisi materi kimia kelas XI yang membahas tentang penentuan perubahan entalpi dengan menggunakan kalorimeter dilengkapi dengan latihan soal dan pe.

Kumpulan Contoh Soal Kalorimetri dan Perubahan Entalpi Reaksi Kimia Kelas 11 CoLearn
Kalor jenis air adalah 4,18 J/ (g·°C). Sebagai contoh, perhatikan reaksi kimia yang terjadi dalam 200 gram air dengan suhu awal 25,0 C. Reaksi dibiarkan berlangsung dalam kalorimeter cangkir kopi. Sebagai hasil dari reaksi, suhu air berubah menjadi 31,0 C. Aliran panas dihitung: q air = 4,18 J/ (g·°C) x 200 gx (31,0 C - 25,0 C) q air = +5,0.
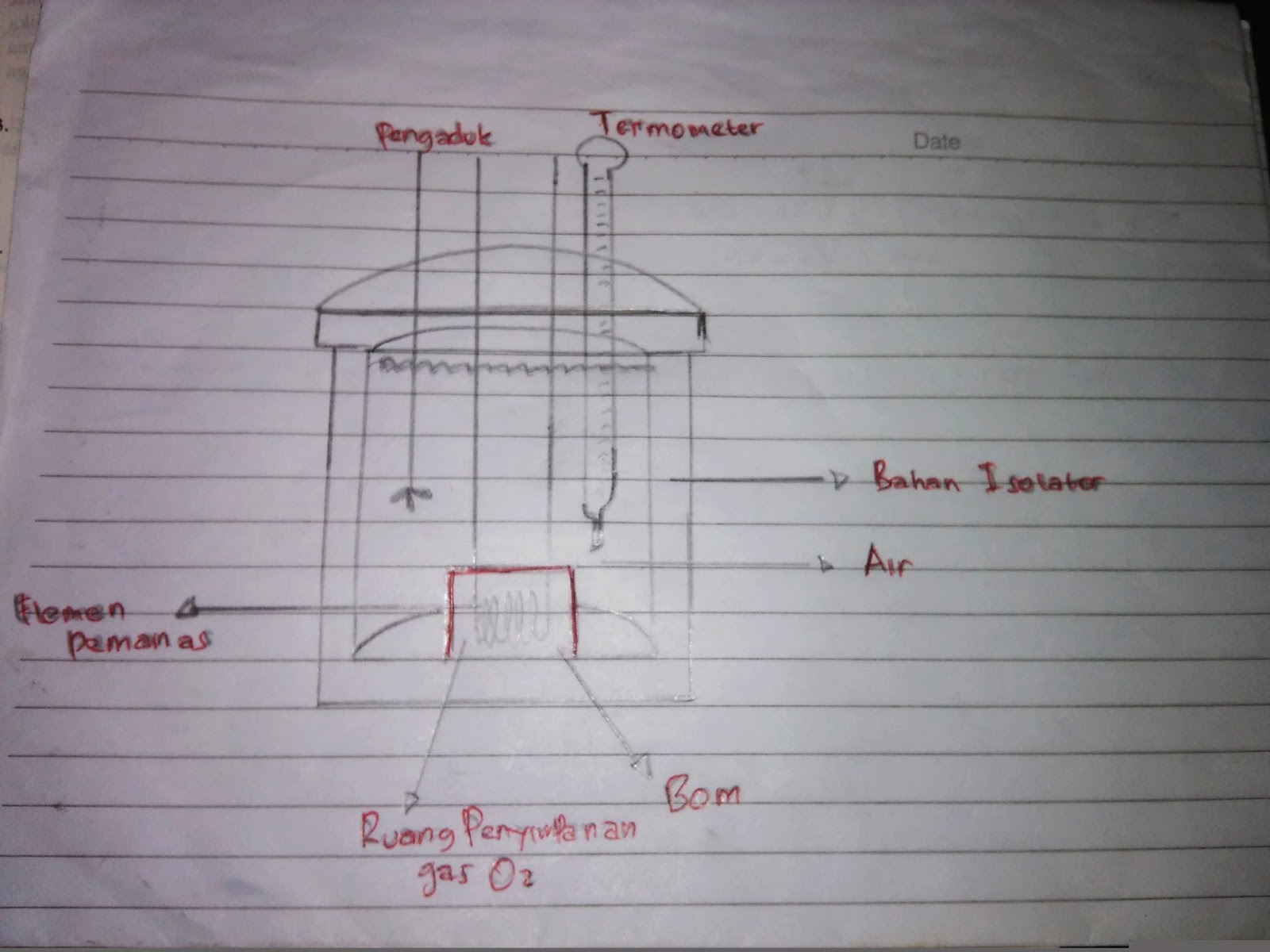
Contoh Soal Kalorimeter Sederhana Dan Bom Terbaru
Persamaan termokimia adalah persaman reaksi setara yang menyertakan kalor reaksi (entalpi reaksi) — yang menunjukkan hubungan antara massa dan energi. Contoh persamaan termokimia: 2H 2 (g) + O 2 (g) → 2H 2 O (g) ΔH= −483,6 kJ. Entalpi, H, yaitu fungsi keadaan yang merupakan jumlah dari energi dalam (E) dan hasil kali dari tekanan (P) dan.

Kumpulan Contoh Soal Kalorimetri dan Perubahan Entalpi Reaksi Kimia Kelas 11 CoLearn
Simak contoh soal kalorimeter kimia yang akan memperdalam pemahaman Anda tentang perhitungan energi panas dalam reaksi kimia. Dalam contoh ini, Anda akan belajar bagaimana menggunakan kalorimeter untuk mengukur perubahan energi dalam sebuah reaksi kimia yang sedang berlangsung. Temukan langkah-langkah yang tepat dalam menghitung kalor reaksi dan analisis data yang akurat guna mendapatkan.