Diketahui reaksi redoks berikut P(s) + NO[3] (aq)...
Menentukan perubahan bilangan oksidasi dan menyamakan perubahan bilangan oksidasinya. 2. Memberikan koefisien reaksi pada reaksi oksidasi dan reduksinya sesuai angka pengalinya. 3. Menyamakan jumlah muatan pada kedua ruas persamaan reaksi. 4. Menyamakan jumlah dengan menambahkan . Maka koefisiennya: Jadi, jawaban yang benar adalah D.

Diketahui reaksi redoks 3 FeCl2 (aq) + H2S (g) > 2 FeCl...
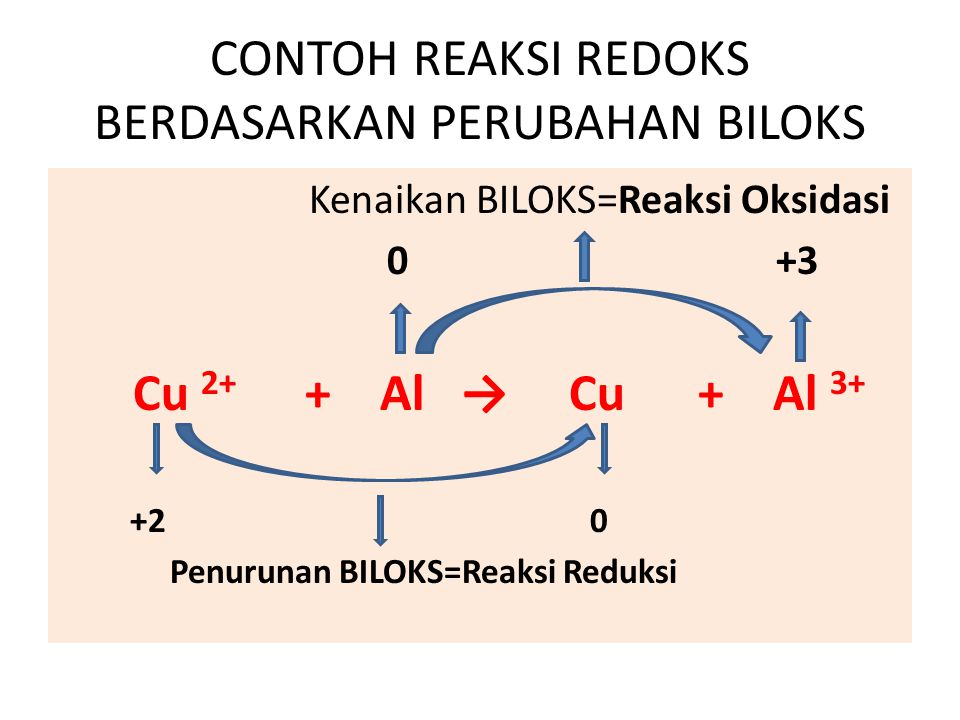
Oke, kita lanjut ya bahasannya! Pada reaksi redoks, terdapat unsur-unsur yang bertindak sebagai reduktor dan oksidator. Zat yang mengalami oksidasi itu disebut reduktor, sedangkan zat yang mengalami reduksi disebut oksidator. Coba perhatikan contoh berikut ini, ya! Reaksi: Mg(s) + 2HCl -----> MgCl2(aq) + H2(g) Karena Mg merupakan unsur bebas, jadi biloks Mg = 0.

Gas Klorin Dapat Dibuat Melalui Reaksi Redoks Berikut
Selain tentang redoks, juga tentang elektrokimia. Silakan bisa kamu pelajari soal un redoks dan pembahasannya ini secara mandiri. Jika ada pertanyaan mengenai soal UN redoks dan elektrokimia bisa ditanyakan melalui kolom komentar. Soal UN Redoks dan Elektrokimia Tahun 2013 dan Pembahasannya. Diketahui beberapa persamaan reaksi berikut:

Diketahui reaksi redoks berikut. Br2 (l) + KOH (aq...
Redoks Redoks atau redox adalah istilah yang menjelaskan berubahnya bilangan oksidasi (keadaan oksidasi) atom-atom dalam sebuah reaksi kimia. Hal ini dapat berupa proses redoks yang sederhana seperti oksidasi karbon yang menghasilkan karbon dioksida, atau reduksi karbon oleh hidrogen menghasilkan metana (CH4), ataupun ia dapat berupa proses yang kompleks seperti oksidasi gula pada tubuh.

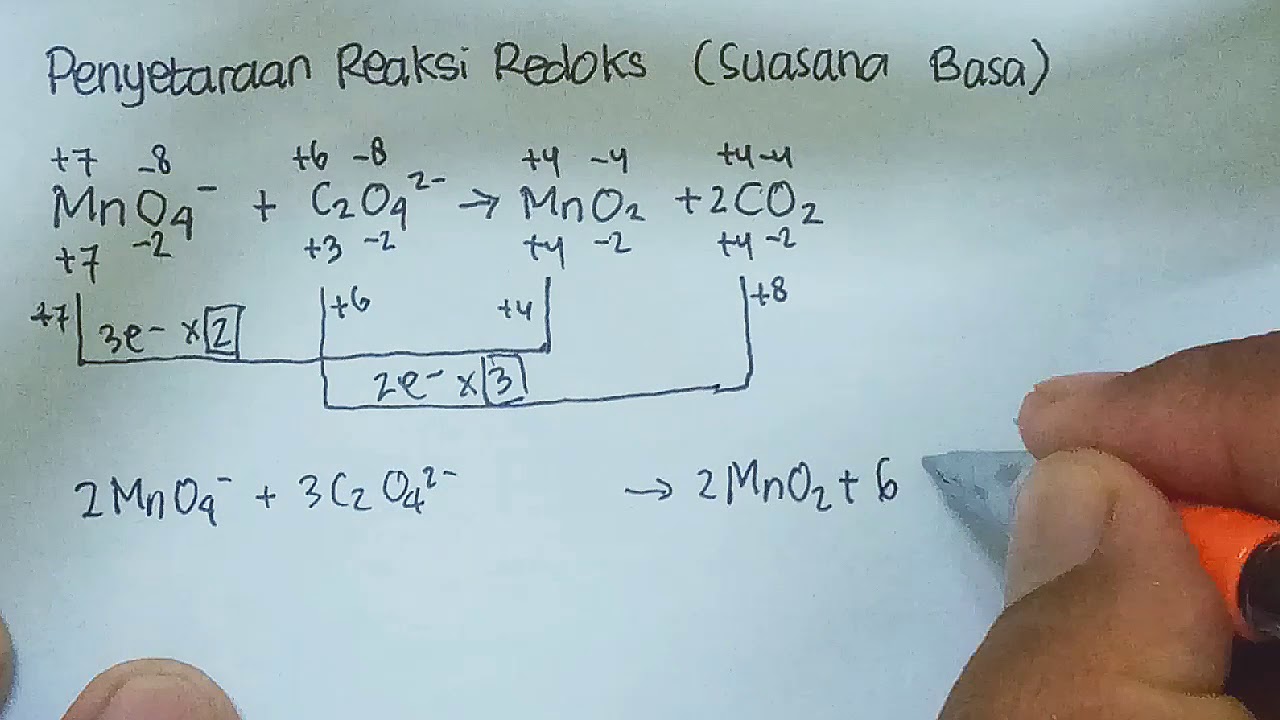
Diketahui persamaan reaksi redoks sebagai berikut.MnO4^
Pemahaman Akhir. Reaksi redoks merupakan reaksi yang terdiri dari reduksi (penerimaan elektron) dan oksidasi (penyisihan elektron). Konsep reaksi redoks dapat dilihat dari berbagai sudut pandang, seperti berdasarkan pengikatan dan pelepasan oksigen, pengikatan dan pelepasan elektron, atau penambahan dan penurunan bilangan oksidasi.

Konsep Reaksi Redoks
Langkah 1: Setarakan jumlah atom yang terlibat dalam reaksi, kecuali atom O dan H. MnO + PbO 2 → MnO 4- + Pb 2+. Langkah 2: Menentukan bilangan oksidasi masing-masing atom dalam reaksi dan menentukan spesi yang mengalami oksidasi serta reduksi. MnO + PbO 2 → MnO 4- + Pb 2+. sumber: dokumentasi pribadi.

Mempelajari Konsep Reaksi Redoks (ReduksiOksidasi) Kimia Kelas 10
Reaksi autoredoks/disproporsionisasi merupakan reaksi redoks dimana satu zat mengalami reaksi reduksi dan oksidasi sekaligus. Contoh: S merupakan hasil reduksi sekaligus hasil oksidasi;. Diketahui persamaan reaksi redoks. KMnO 4 (aq) + KI(aq) + H 2 SO 4 (aq) → MnSO 4 (aq) + I 2 (aq) + K 2 SO 4 (aq) +H 2 O(l)

Diketahui persamaan reaksi redoks berikut aCr2O7^(2)
Remidi Kimia Kelas Xii.IPA. Redoks Approved & Edited by ProProfs Editorial Team The editorial team at ProProfs Quizzes consists of a select group of subject experts, trivia writers, and quiz masters who have authored over 10,000 quizzes taken by more than 100 million users.
Contoh Soal Reaksi Redoks Dan Pembahasannya
Halo Koperasi di sini ada soal tentang penyetaraan reaksi redoks setengah reaksi oksidasi dari reaksi tersebut adalah yang mana Oke jadi di sini ada aturan bilangan oksidasi atau biloks yang pertama biloks unsur bebas akan sama dengan nol yang kedua jumlah dilaksanakan dalam yang sama dengan muatannya yang ketiga. Jumlah bilangan unsur-unsur.

Diketahui reaksi redoks setara berikut; 3As + 5NO3^ + 4O...
Diketahui reaksi redoks (belum setara) sebagai berikut: BrO3^- + Br^- + H^+ -> Br2 + H2O Untuk menghasilkan 0,3 mol Br2 diperlukan ion Br^- (Ar = 80) sebanyak. Penyetaraan Persamaan Reaksi Redoks. Reaksi Redoks dan Sel Elektrokimia. Kimia Fisik dan Analisis.
Soal Reaksi Redoks Kelas X Semester 2
Reaksi redoks adalah reaksi kimia di mana reduksi dan oksidasi terjadi. Langkah pertama dalam menyelesaikan setiap reaksi redoks adalah menyetarakan persamaan redoks.. Soal Reaksi Redoks. Diketahui persamaan redoks setara berikut untuk reaksi antara MnO 4 -dan Fe 2+ dalam larutan asam: MnO 4 -(aq).

Diketahui reaksi redoks berikut. Br2 (l) + KOH (aq...
Adapun fungsi reaksi redoks dalam kehidupan sehari-hari, antara lain: - Untuk memahami fenomena korosi logam dan cara pencegahannya. - Penggunaan lumpur aktif untuk mengolah limbah. - Mengetahui reaksi fotosintesis. - Oksidasi makanan dalam sel. - Mur dan baut diberi lapisan zinc, di mana dalam lapisan itu terdapat proses oksidasi logam zinc.
Contoh Reaksi Redoks Dalam Kehidupan Sehari Hari Beserta Reaksinya Berbagai Contoh
Indikator Titrasi Reduksi Oksidasi (Redoks) Titik akhir dari titrasi redoks dapat ditetapkan secara visual melalui reaksi redoks itu sendiri. Perubahan warna pada saat titik akhir tercapai dapat diketahui dengan penambahan indikator. Indikator merupakan senyawa organik yang dapat mengalami perubahan warna apabila terjadi perubahan biloks.

Diantara reaksireaksi dibawah ini yang merupakan reaksi redoks adalah . . . a. AgNO3 (aq
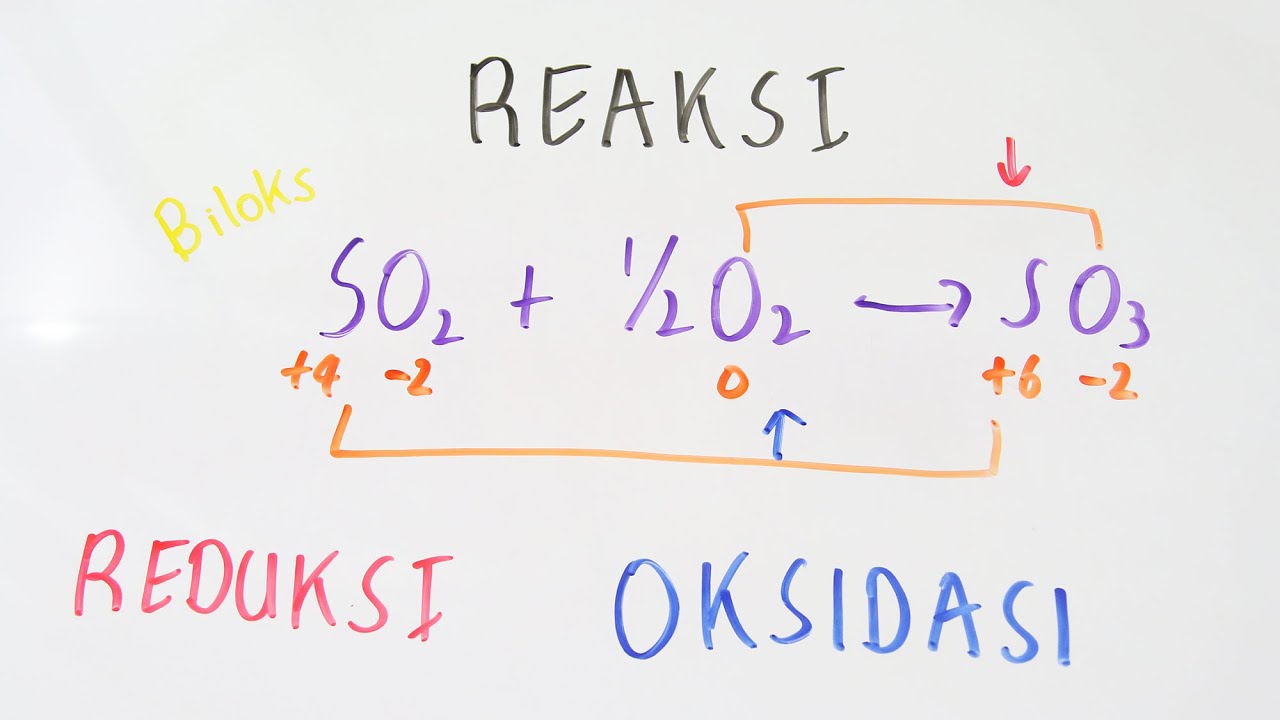
Reaksi redoks dapat dibedakan berdasarkan perubahan bilangan oksidasi, sehigga untuk menentukan spesi yang mengalami reduksi dan oksidasi, perlu diketahui nilai biloksnya. Penentuan Bilangan Oksidasi Penentuan bilangan oksidasi dapat dilakukan dengan mengikuti aturan berikut [3, 4].

Diketahui suatu reaksi redoks sebagai berikut. aBr^ + b...
45+ Soal Penyetaraan Reaksi Redoks (Reduksi dan Oksidasi) [Update] Pada tahun 1774 seorang ilmuan bernama Joseph Priestley yang tercatat dalam sejarah melakukan penelitian terhadap oksigen di laboratorium dimana reaksi bersejarah ini juga merupakan reaksi oksidasi-reduksi. Priestley memanaskan merkuri oksida dan membentuk unsur merkuri dan oksigen.

Diketahui reaksireaksi redoks dalam industri berikut. (1...
Proses redoks menjadi sumber utama energi dalam beragam proses biologis dan industri. Sebagai contoh, dalam proses metabolisme, oksidasi senyawa organik seperti glukosa menghasilkan energi yang digunakan oleh sel. Di sektor industri, reaksi redoks diterapkan dalam pembangkit listrik, seperti dalam sel bahan bakar. 3. Penggunaan Bahan Bakar.