Chocogreentea Keterbatasan Teori AsamBasa Bronsted Lowry
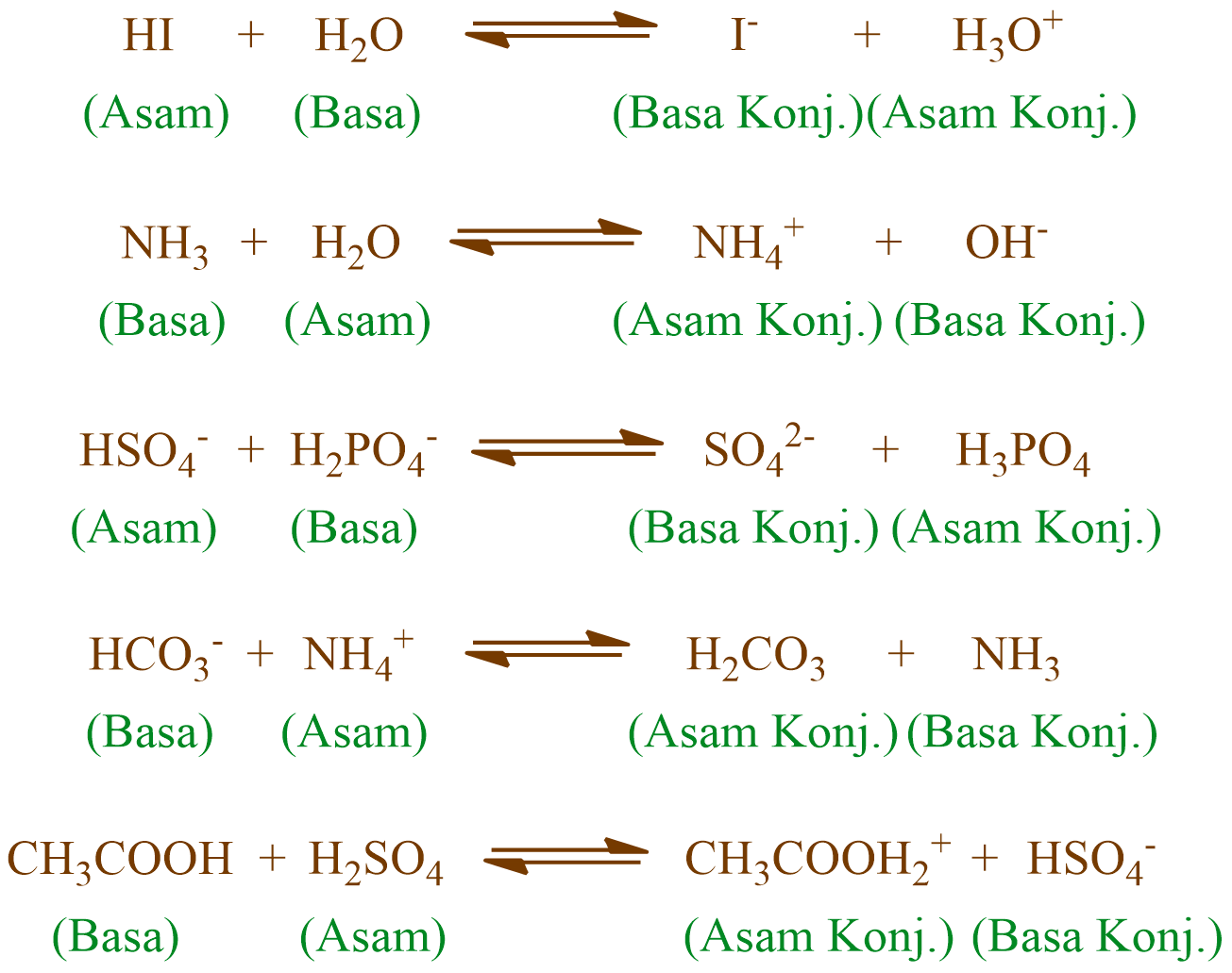
Asam dan basa adalah larutan elektrolit yang dikenal dengan ciri khasnya, seperti asam yang memiliki rasa masam dan basa yang memiliki rasa pahit. Asam dan basa pengertian menurut Kamus Besar Bahasa Indonesia (KBBI), asam adalah zat yang dapat memberikan proton, zat yang dapat membentuk ikatan kovalen dengan menerima sepasang elektron.

Asam Basa Teori, Contoh, dan Sifat Asam Basa InformasainsEdu
Proses titrasi asam basa melibatkan larutan asam kuat atau basa kuat yang bisa berbahaya bagi tubuh, jadi harus dilakukan di dalam laboratorium dengan didampingi oleh guru atau asisten laboratorium. Sebelum melakukan eksperimen ini pun, kamu harus mengenakan alat pelindung diri seperti baju atau jas lab, sarung tangan, dan kacamata ( goggles.

Cara Menentukan Senyawa Bersifat Asam Basa Atau Netral Digunakan
Asam asetat adalah sejenis asam lemah. Ketika larutan asam asetat dilarutkan dalam air, sebagian molekulnya akan terionisasi menjadi ion hidrogen (H+) dan ion asetat (CH3COO-). Namun, sebagian besar molekul asam asetat tetap utuh dan tidak terionisasi.

Mengenal Asam Basa Sifat, Cara Membedakan, dan Klasifikasinya Kimia Kelas 11
Mengenal Asam dan Basa Sebelum masuk ke tabel asam basa kuat dan lemah, ada baiknya kita memahami terlebih dahulu apa itu asam dan basa. Keduanya adalah istilah yang digunakan untuk menggambarkan sifat-sifat kimia yang mendasari banyak fenomena dalam kehidupan sehari-hari kita.
Nama Asam Dan Basa Beserta Rumus Kimianya
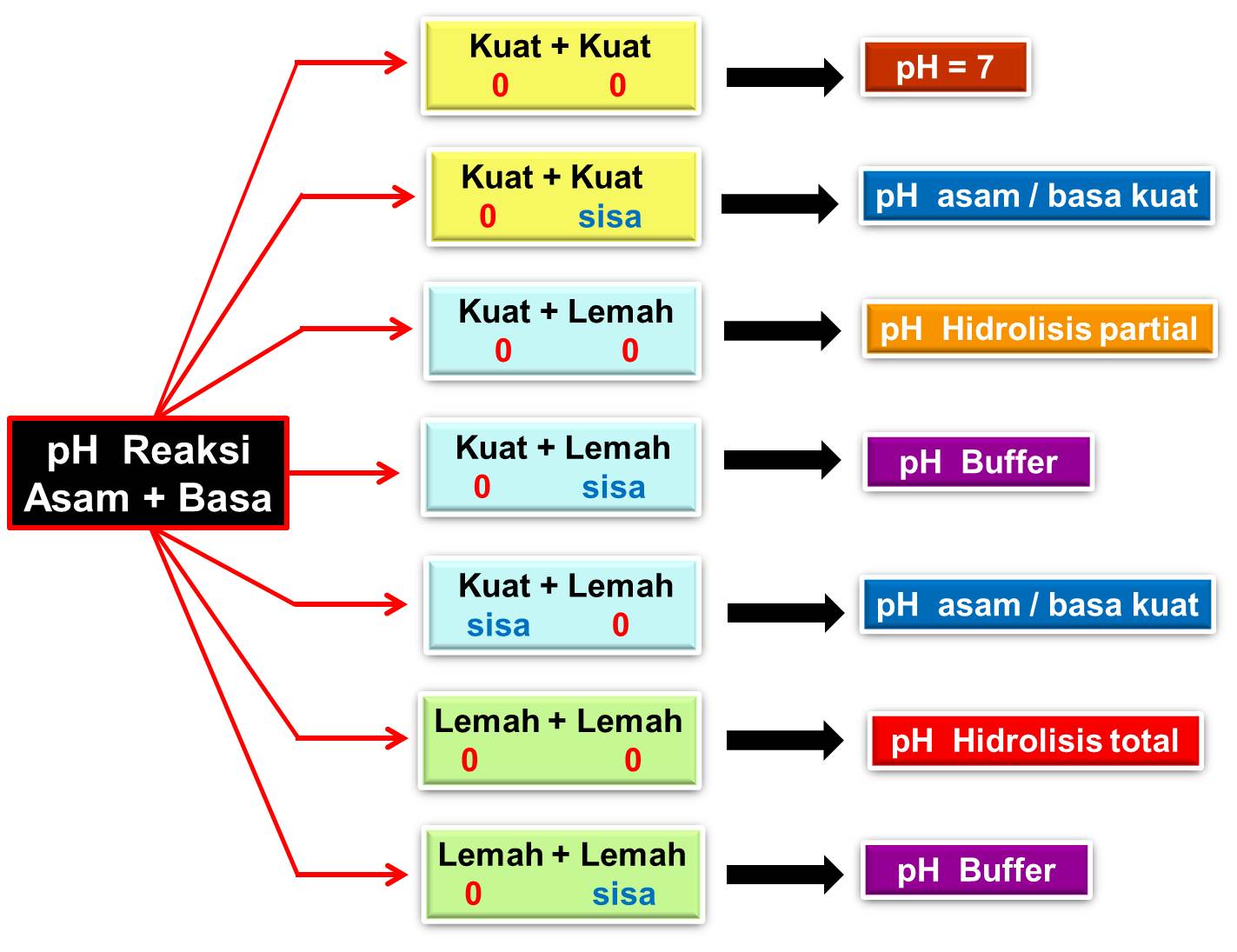
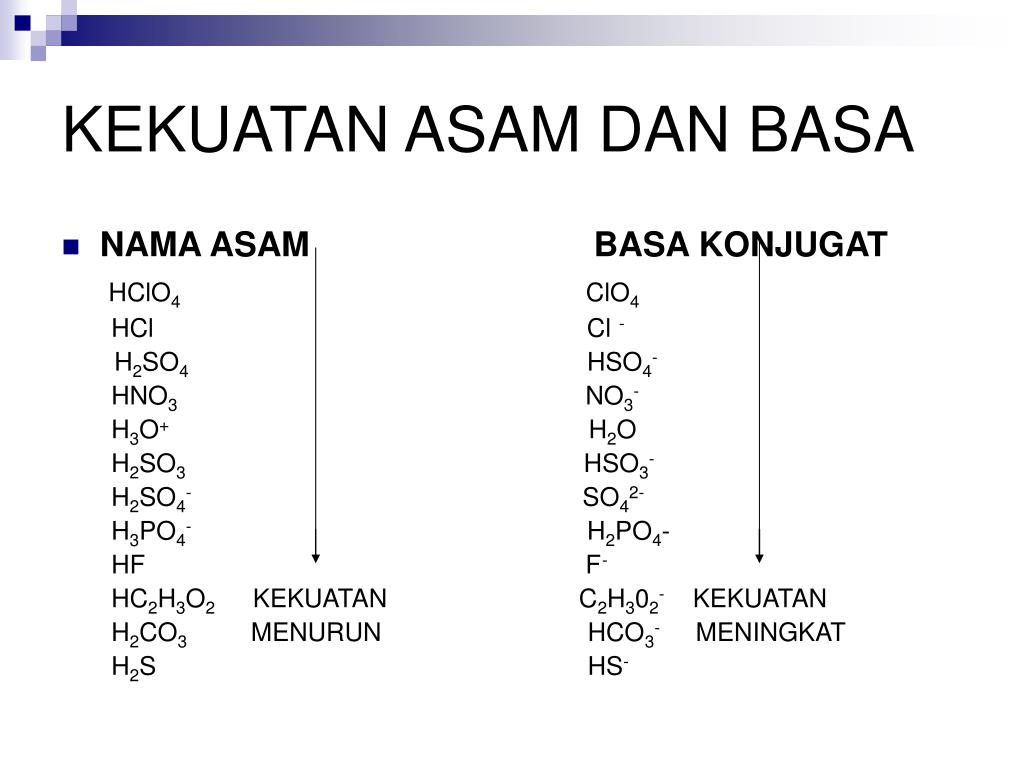
Pembahasan Larutan penyangga adalah larutan yang digunakan untuk menstabilkan pH saat ada penambahan asam, basa, atau garam. Larutan ini dibentuk lewat reaksi antara asam lemah dan basa konjugasinya, serta basa lemah dan asam konjugasinya . Larutan penyangga ada 2 jenis, larutan penyangga asam dan larutan penyangga basa.

LENGKAP ‼️ Cara Mudah Menentukan Pasangan Asam Basa Konjugasi TeoriAsamBasa AsamBasaKonjugasi
Artikel ini juga merupakan penjelas bagi artikel sebelumnya mengenai Cara Menentukan Besar pH Larutan Asam-Basa. Yuk Berlatih!!. = 0,45 M atau 4,5 × 10-1. Dengan demikian diperoleh, pOH = - log [OH-] pOH = - log 4,5 × 10-1. Sebanyak 100 mL larutan KOH 0,8 M direaksikan dengan 100 mL larutan HCOOH 0,8 M sesuai dengan reaksi: HCOOH.
Contoh Asam Basa Kuat Dan Lemah Serta Reaksi Ionisasinya Berbagai Contoh
Apa yang dimaksud dengan larutan asam basa? Kita mulai dari larutan asam dahulu yuk, Sobat. Larutan asam adalah larutan yang memiliki pH kurang dari 7. Eh, apa pula pH itu? pH adalah ukuran yang digunakan untuk menentukan tingkat keasaman atau kebasaan suatu larutan. Sifat asam dan basa suatu larutan ditentukan oleh kandungannya.
CINTA KIMIA PETA KONSEP pH REAKSI ASAM BASA
The hotels on the westside of Oahu are all located in the same area, called Ko'olina. The three largest hotels on Oahu's west coast are the Four Seasons, the Marriott and the Aulani Disney Resort. The hotels are all about 45 minutes by car from the airport or Honolulu, but during rush hour, the drive can take up to two hours.

Pengertian Asam dan Basa Serta Penggunaannya
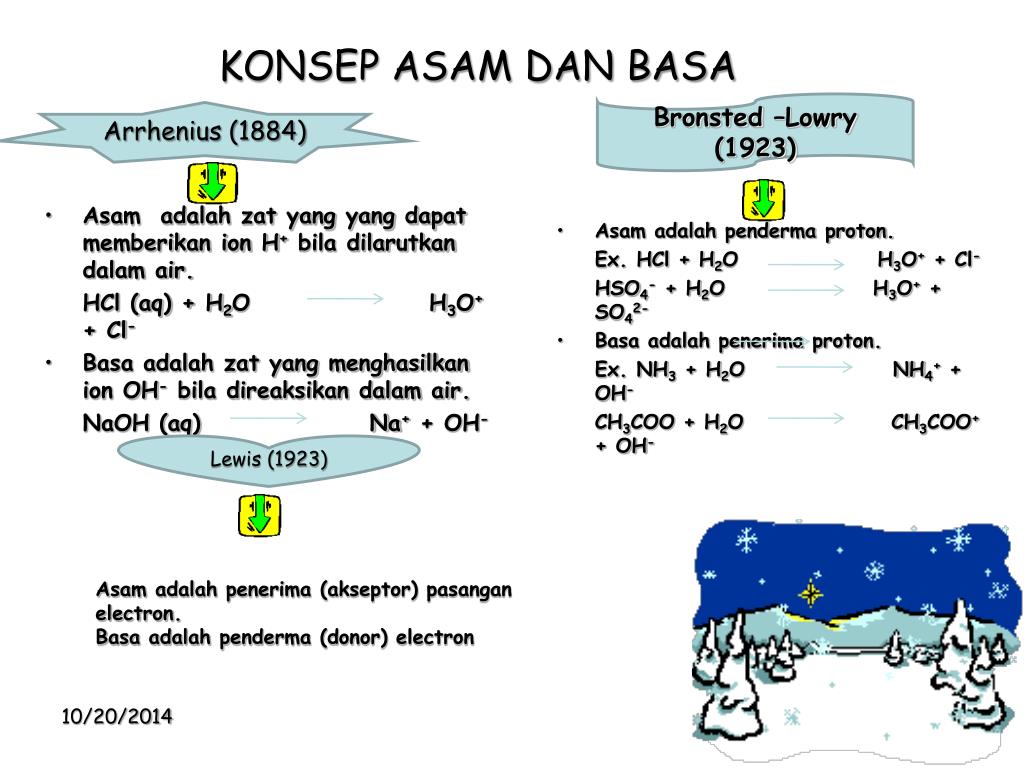
Dalam ilmu kimia saat ini, asam diartikan sebagai senyawa yang jika dilarutkan dalam air maka pH nya < 7 atau lebih kecil dari 7. Hal itu memang benar karena sifat-sifat yang dimiliki oleh senyawa asam antara lain adalah: 1. Rasanya pada umumnya masam karena mengandung asam sitrat (pada buah-buahan) 2. Sebagian besar larut dalam air 3.

PPT TEORI ASAM DAN BASA PowerPoint Presentation, free download ID3560268
Kalau pada suhu 25℃, pH < 7 bersifat asam, pH = 7 bersifat netral, dan pH > 7 bersifat basa. Derajat keasaman dan kebasaan suatu larutan. (dok. Flickr/boellstiftung) Semakin kecil nilainya, maka larutan tersebut akan semakin asam. Misalnya antara larutan dengan pH 3 dan 1, akan lebih kuat konsentrasi asam dengan pH 1 daripada 3.
Hcooh Termasuk Asam Atau Basa World of Nirmala
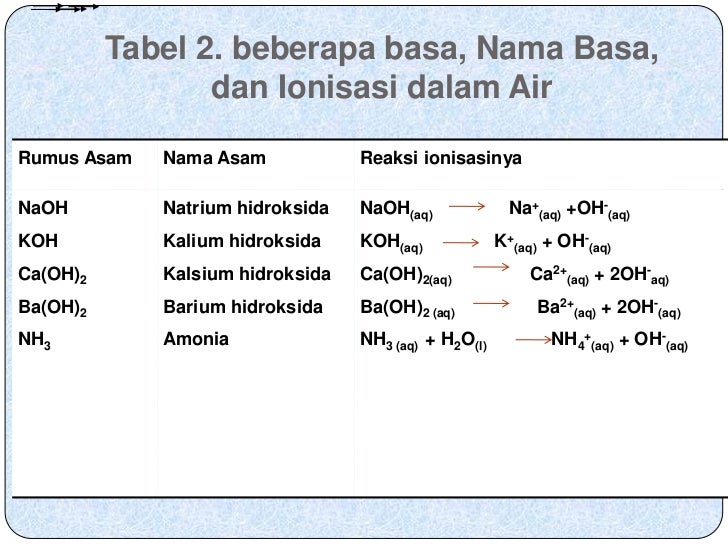
asam lemah (contoh: HF, HCN, HNO 2, CH 3 COOH, H 2 CO 3) Dalam air, hanya sebagian asam lemah terurai menjadi ion-ionnya, sehingga derajat ionisasinya 0 < α < 1. Jika konsentrasi awal larutan asam lemah HA dinyatakan sebagai M a, maka: HA (aq) ⇌ H + (aq) + A − (aq) Mula-mula : M a Reaksi : −αM a + αM a + αM a Setimbang : (1 − α)M a αM a αM a
PPT ASAM DAN BASA PowerPoint Presentation, free download ID1244635
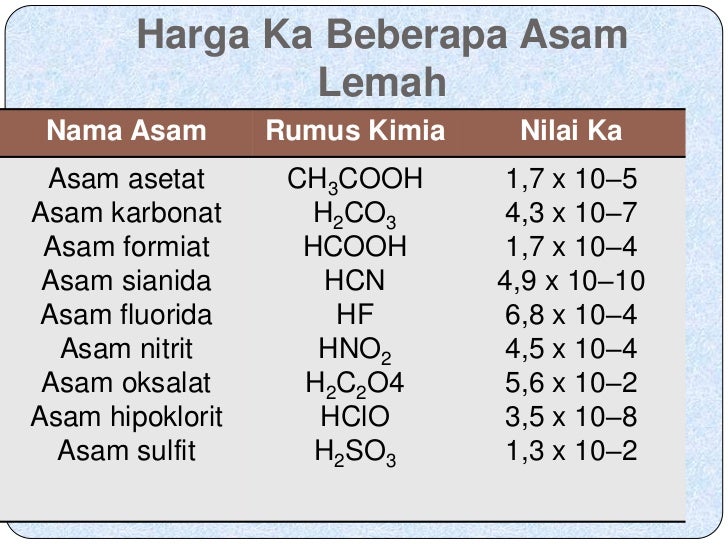
Basa kuat adalah hidroksida-hidroksida logam alkali dan alkali tanah yang larut (Ca2+, Sr2+, and Ba2+). Zat-zat ini juga terdisosiasi sempurna dalam larutan air memberikan ion hidroksi (OH-). Berdasarkan definisi merupakan elektrolit kuat dan berada sempurna sebagai ion-ion dalam larutan air. Untuk basa kuat → [OH-] = [basa].

Teori Asam Basa
sehingga didapatkan rumus perhitungan konsentrasi titrasi asam basa sebagai berikut: V 1 x K 1 = V 2 x K 2 K 2 = (V 1 x K 1 V 2 Dimana: V 1 = volume analit atau zat yang dititrasi; K 1 = konsentrasi zat yang dititrasi; V 2 = volume titran terpakai; K 2 = konsentrasi titran. Jika zat asam atau basa dalam titrasi memiliki valensi lebih dari 1.
PPT ASAM BASA PowerPoint Presentation, free download ID5640840
Di artikel Kimia kelas 11 ini, kita akan belajar mengenai macam-macam indikator asam basa dan cara menggunakannya. Yuk, baca sampai habis! Teman-teman, di artikel sebelumnya, kamu sudah mengenal apa itu zat asam-basa dan cara membedakannya, ya. Senyawa asam akan mengandung ion H +. Contohnya buah-buahan kaya vitamin C, cuka, minuman bersoda, dsb.
PPT ASAM DAN BASA PowerPoint Presentation, free download ID1244635
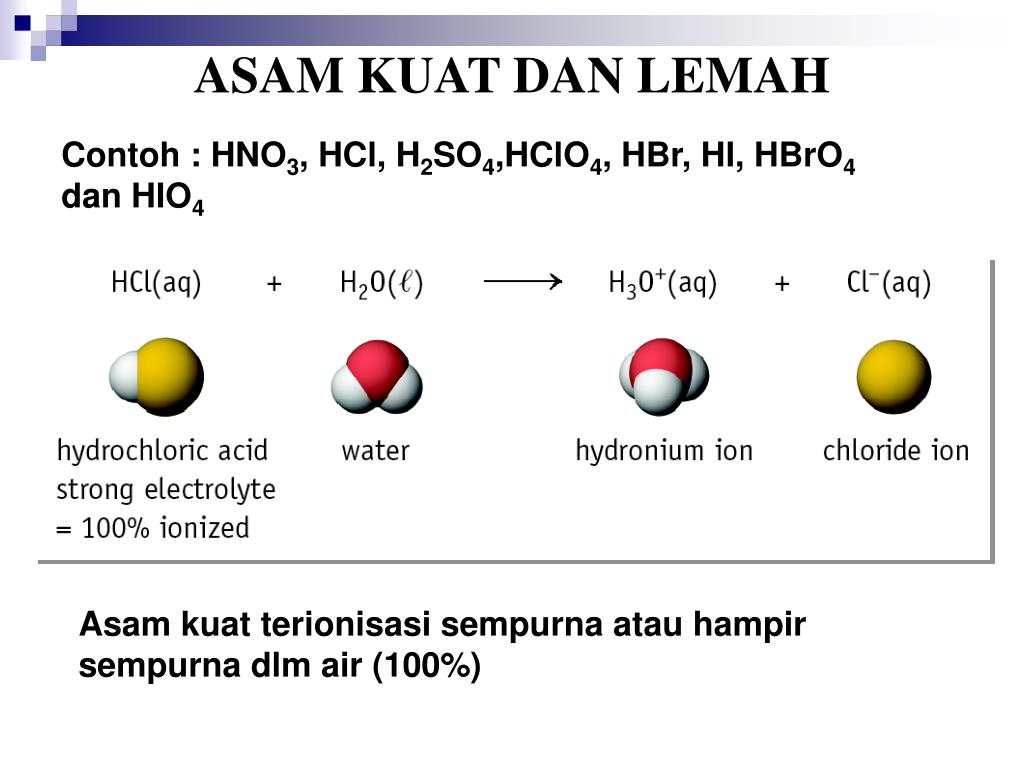
Berikut adalah daftar nama asam kuat: Asam klorida (HCl) Asam nitrat (HNO3) Asam sulfat (H2SO4) Asam klorat (HClO3) Asam perklorat (HClO4) Asam bromida (HBr) Asam hidrogen iodida (HI) Baca juga: Hujan Asam: Penyebab, Proses, Dampak, dan Cara Mencegahnya Asam lemah Asam lemah adalah larutan dengan pH di bawah tujuh dan di atas tiga.
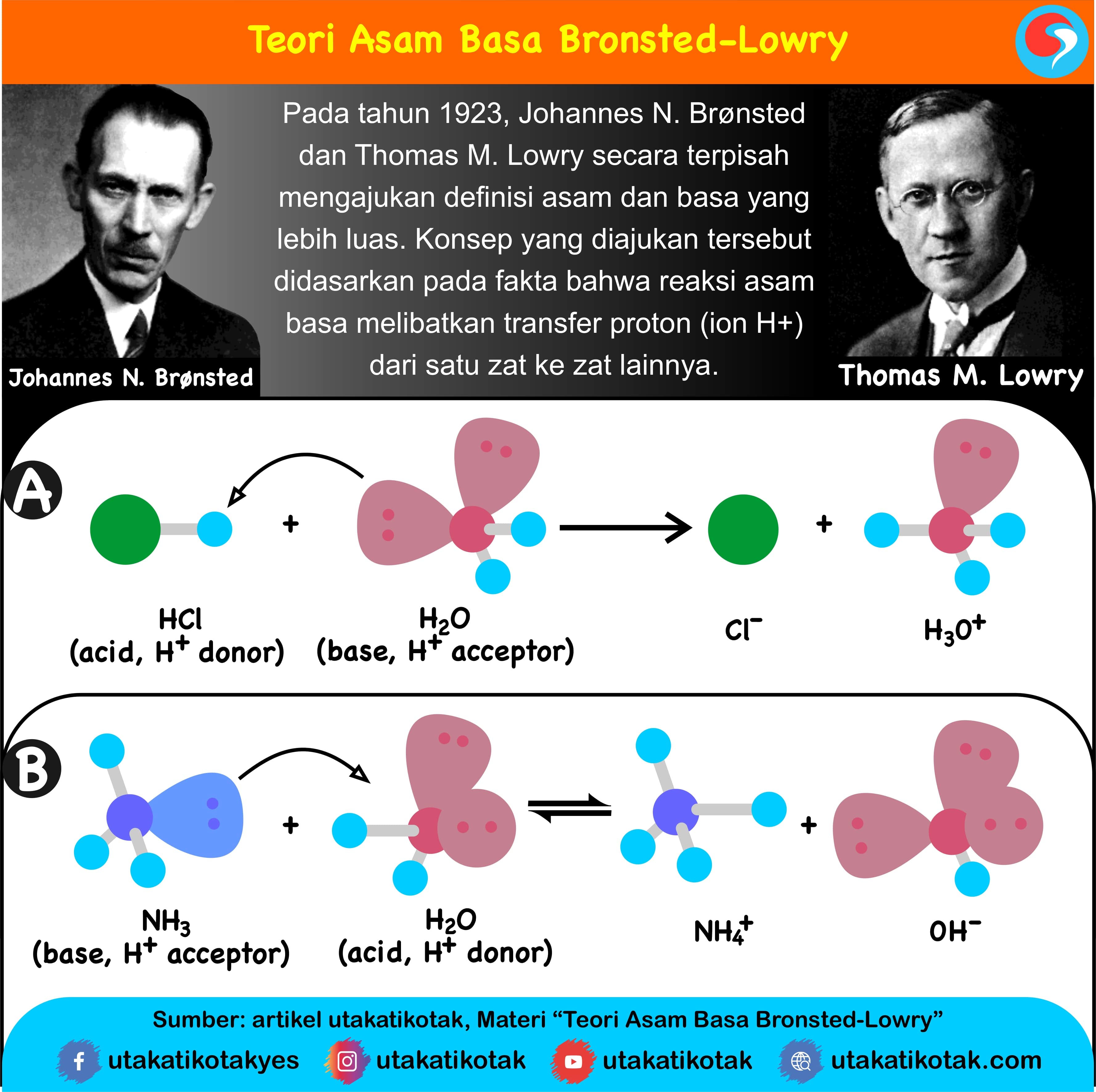
Teori Asam dan Basa Menurut BronstedLowry
Asam bromida (HBr) Asam sulfat (H2SO4) Asam klorat (HClO3) Sementara itu, basa kuat merupakan senyawa basa yang dapat dengan mudah melepaskan ion OH- di dalam air dan dalam larutannya terjadi disosiasi total. Misalnya seperti: Barium hidroksida (Ba (OH2) Stronsium hidroksida (CsOH) Kalsium hidroksida (Ca (OH2) Litium hidroksida (LiOH)