
Lihatlah Menurut Teori AsamBasa BronstedLowry Asam Didefinisikan Sebagai Zat Yang Sedang Trend
1. Memiliki persamaan dengan teori Bronsted dan Lowry, yaitu dapat menjelaskan sifat asam basa dalam pelarut lain maupun tidak punya pelarut. 2. Teori asam basa Lewis mampu menjelaskan sifat asam basa molekul atau ion yang punya pasangan elektron bebas atau yang dapat menerima pasangan elektron bebas, semisal pada pembentukan senyawa kompleks.
Chocogreentea Keterbatasan Teori AsamBasa Bronsted Lowry
Arrhenius menjelaskan asam sebagai zat yang ketika dilarutkan dalam air menghasilkan ion hidronium (H+). Sedangkan basa menurut Arrhenius adalah zat yang dapat menghasilkan ion hidroksida (OH−) ketika dilarutkan dalam air. Contohnya HCl, HBr, NaOH, KOH. Bronsted-Lowry mendeskripsikan asam sebagai zat yang mampu memberikan ion H+ (donor proton.

Teori Asam Dan Basa Menurut Arrhenius Bronsted Lowry Dan Lewis Ezy Blog My XXX Hot Girl
Zat asam dan basa dijelaskan dalam teori oleh beberapa pakar kimia, di antaranya teori Arrhenius, Bronsted-Lowry, dan Lewis. Asam-basa adalah sifat kimiawi yang dimiliki oleh bahan makanan, minuman, obat-obatan, dan zat lainnya. Disebutkan dalam laman Sumber Belajar Kemdikbud, bahwa secara umum asam mempunyai rasa masam dan basa mempunyai rasa.

TEORI ASAM BASA ARHENIUS, BRONSTED LOWRY, DAN LEWIS YouTube
Berikut penjelasan teori asam dan basa dari Arrhenius, Bronsted-Lowry, dan Lewis: Teori Asam Basa Arrhenius. Teori asam basa Arrhenius dikemukakan oleh Swedia Svante Arrhenius pada tahun 1884 menjadikannya teori pertama yang mengklasifikasikan senyawa menjadi asam dan basa. Dilansir dari Chemguide, menurut Arrhenius, asam adalah zat yang.

Konsep Mudah Belajar Teori Asam Basa BronstedLowry Kimia SMA YouTube
Verifying that you are not a robot.

Asam Basa Teori, Contoh, dan Sifat Asam Basa InformasainsEdu
Penjelasan Lengkap: jelaskan pengertian asam basa menurut arrhenius bronsted lowry dan lewis 1. Svante Arrhenius mengembangkan teori Asam Basa Arrhenius pada tahun 1887 yang menyatakan bahwa asam adalah senyawa yang menghasilkan ion hidrogen (H+) saat larut dalam air, sedangkan basa adalah senyawa yang menghasilkan ion hidroksida (OH-) saat larut dalam air.
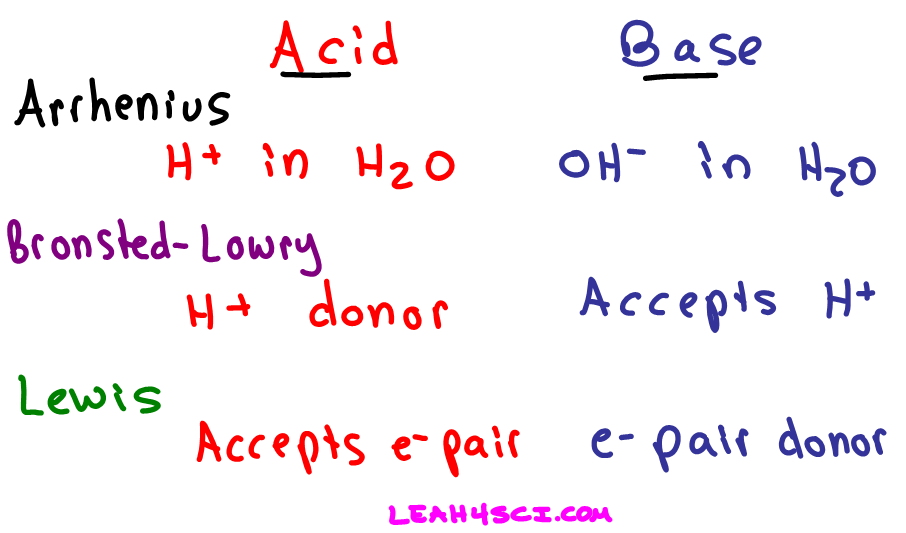
Definitions of Arrhenius, BronstedLowry, and Lewis Acids and Bases in Organic Chemistry
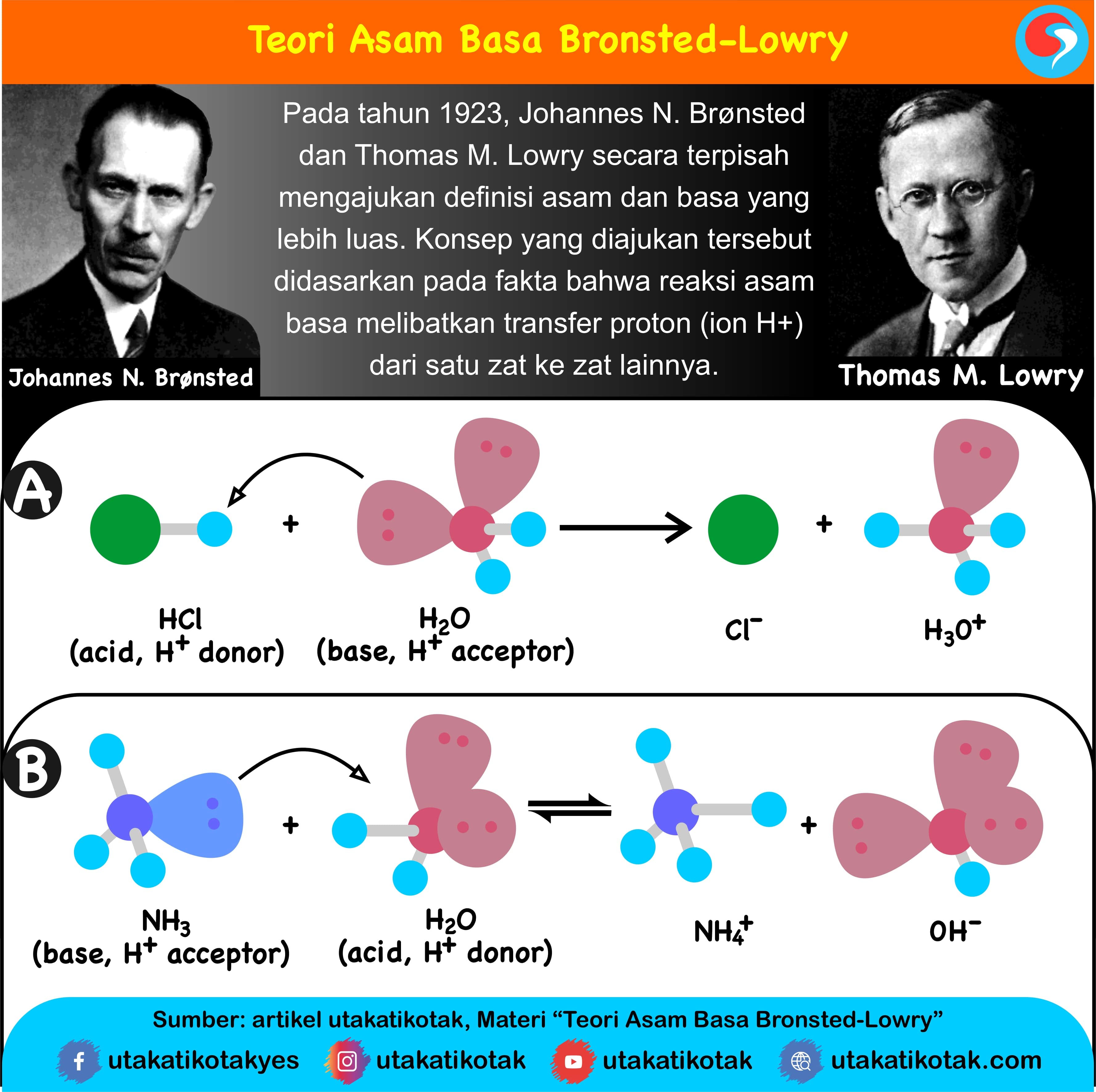
Setidaknya, ada tiga teori asam basa yang dikemukakan oleh para ahli, yaitu teori asam basa menurut Arrhenius, Bronsted-Lowry, dan Lewis. Berikut penjelasan lebih lanjutnya.. Tahun 1923, seorang ahli dari Denmark bernama Johanes N. Bronsted dan Thomas M. Lowry dari Inggris mengajukan konsep tentang asam basa secara terpisah, tapi dalam waktu.

LENGKAP ‼️ Cara Mudah Menentukan Pasangan Asam Basa Konjugasi TeoriAsamBasa AsamBasaKonjugasi
Assalamu'alaikum warahmatullahi wabarakatuh. Hai, semua! Selamat datang di channel Cerdas Kimia. Video berisi penjelasan teori Asam Basa 1. Arrhenius 2. Bron.

LENGKAP ‼️ Teori Asam Basa Lewis Latihan Soal dan Pembahasan YouTube
Tahun: 1886. Pada tahun 1886, seorang ilmuan berkebangsaan Swedia yang bernama Svante August Arrhenius mengemukakan teori mengenai asam dan basa. Teorinya tersebut diuraikan sebagai berikut. Menurut Arrhenius, asam adalah zat yang menghasilkan ion hidronium (H3O+) atau ion hidrogen (H+) apabila dilarutkan dalam air.

Contoh Soal menentukan pasangan asam basa konjugasi menurut BronstedLowry YouTube
Teori Bronsted-Lowry. Teori Bronsted-Lowry yang dikemukakan oleh Johannes Nicolaus Bronsted dan Thomas Martin Lowry pada tahun 1923 mengembangkan konsep asam basa dari sudut pandang transfer proton. Menurut teori ini, asam adalah zat yang dapat menyumbangkan proton (H+), sedangkan basa adalah zat yang dapat menerima proton.
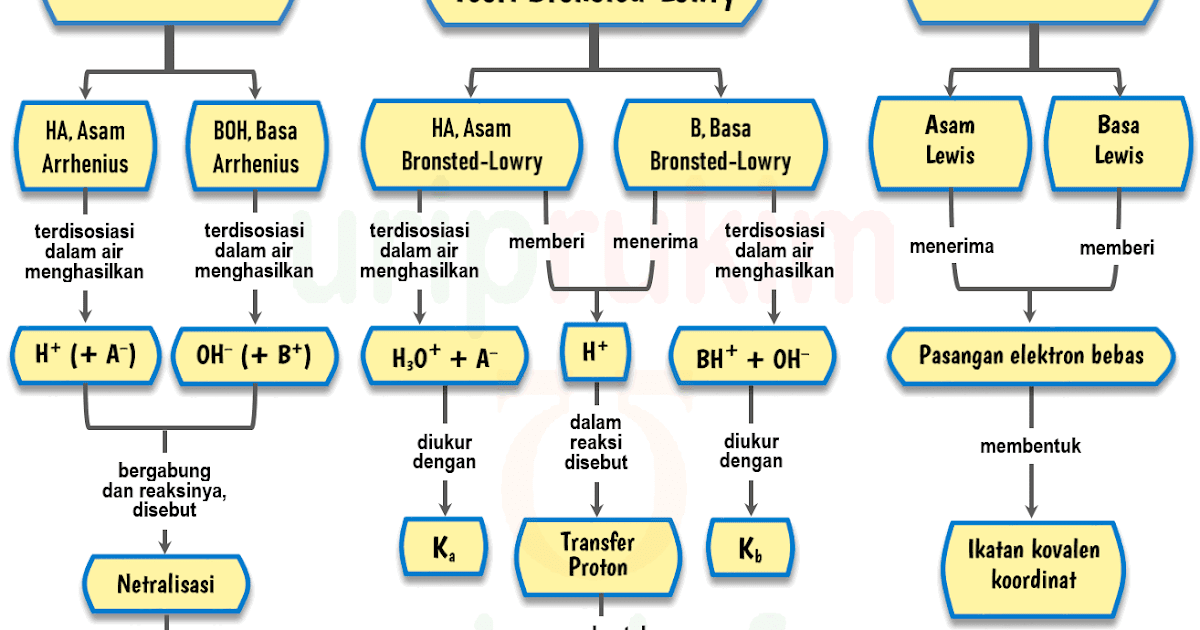
Unduh Skema Teori AsamBasa (Arrhenius, BronstedLowry, Lewis) Urip dot Info
2. Teori Asam Basa Bronsted dan Lowry Teori asam basa yang kedua merupakan teori asam basa yang muncul untuk dapat menyempurnakan kekurangan yang ada pada teori Arrhenius. Yaitu dengan keterbatasan pelarut, yaitu hanya senyawa air saja serta dapat menjelaskan reaksi dari asam basa yang terjadi pada fase cair, gas, serta fase padat pula.

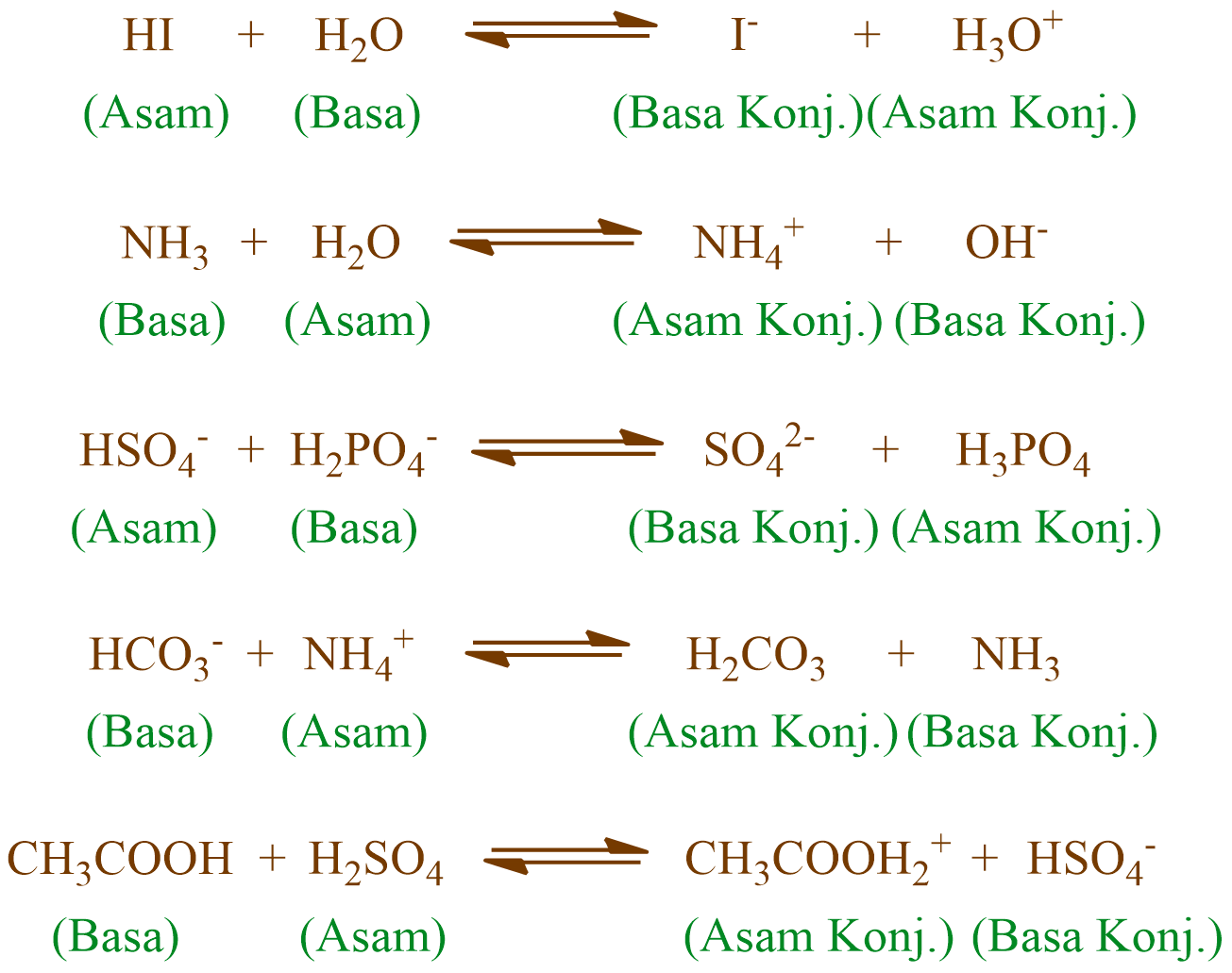
Jelaskan sifat asambasa pada reaksireaksi berikut mengg...
Konsep asam basa dari Arrhenius, Bronsted-Lowry, dan Lewis.di video ini juga membahas mengenai keunggulan dan kelemahan setiap teori mereka.Konsep Asam-Basa.
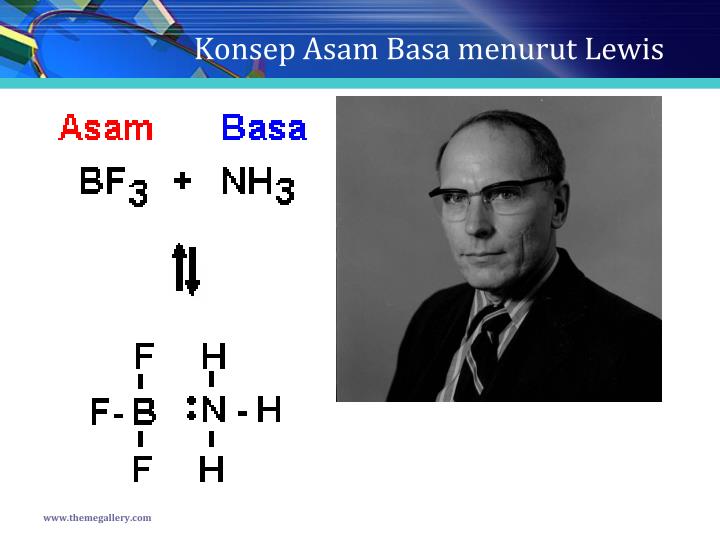
Konsep Asam Basa Menurut Lewis Pengertian Dan Contohnya Jempol Kimia Riset
Kelebihan asam basa Lewis. Teori asam basa Lewis memiliki kelebihan sebagai berikut: 1. Memiliki persamaan dengan teori Bronsted dan Lowry, yaitu dapat menjelaskan sifat asam, basa dalam pelarut lain maupun tidak mempunyai pelarut. 2. Teori asam basa Lewis mampu menjelaskan sifat asam basa molekul atau ion yang mempunyai pasangan elektron bebas.

Teori Asam Basa
Basa menurut Arrhenius adalah senyawa yang jika dilarutkan dalam air akan menghasilkan ion. Basa menurut Bronsted-Lowry adalah penerima/akseptor proton () Asam menurut Lewis adalah penerima/akseptor Pasangan Elektron Bebas (PEB) Basa menurut Lewis adalah pemberi/donor Pasangan Elektron Bebas (PEB).
Teori Asam dan Basa Menurut BronstedLowry
Teori Asam Basa Brønsted-Lowry. Pada tahun 1923, ahli kimia Johannes Nicolaus Bronsted dan Thomas Martin Lowry mengembangkan definisi asam dan basa berdasarkan kemampuan (donor) atau menerima (akseptor) proton (ion H + ). Menurut konsep Bronsted dan Lowry, zat yang memiliki kecenderungan untuk menyumbangkan ion H+ pada zat lain adalah asam.

Asam Basa Teori, Contoh, dan Sifat Asam Basa InformasainsEdu
Teori Asam Basa Arrhenius. Teori ini pertama kalinya dikemukakan pada tahun 1884 oleh Svante August Arrhenius. Menurut Arrhenius, definisi dari asam dan basa, yaitu: asam adalah senyawa yang jika dilarutkan dalam air melepaskan ion H +. basa adalah senyawa yang jika dilarutkan dalam air melepaskan ion OH −.