
Setarakanlah reaksi redoks berikut dengan menggunakan metode bilangan oksidasi! YouTube
Dalam kimia, bilangan oksidasi, biloks, atau keadaan oksidasi, adalah muatan hipotesis sebuah atom jika semua ikatannya dengan atom yang berbeda sepenuhnya ionik.. Pada tahun 1990, IUPAC menggunakan metode postulatori (berbasis aturan) untuk menentukan bilangan oksidasi.

Setarakan Reaksi Redoks Berikut Dengan Metode Bilangan Oksidasi
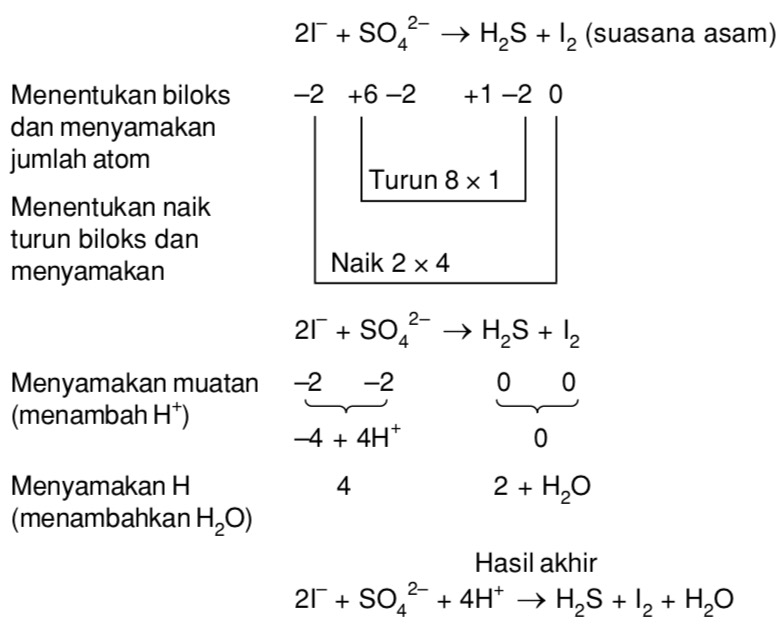
Cara menyetarakan reaksi redoks dengan metode bilangan oksidasi didasarkan pada kekekalan muatan, yakni kenaikan biloks atom teroksidasi harus sama dengan penurunan biloks atom tereduksi. Cara menyetarakan reaksi redoks dengan metode bilangan oksidasi dilakukan dengan beberapa tahapan sebagai berikut: Menentukan bilangan oksidasi semua atom untuk mengetahui atom-atom yang mengalami perubahan.
Setarakan Reaksi Redoks Berikut Dengan Metode Bilangan Oksidasi
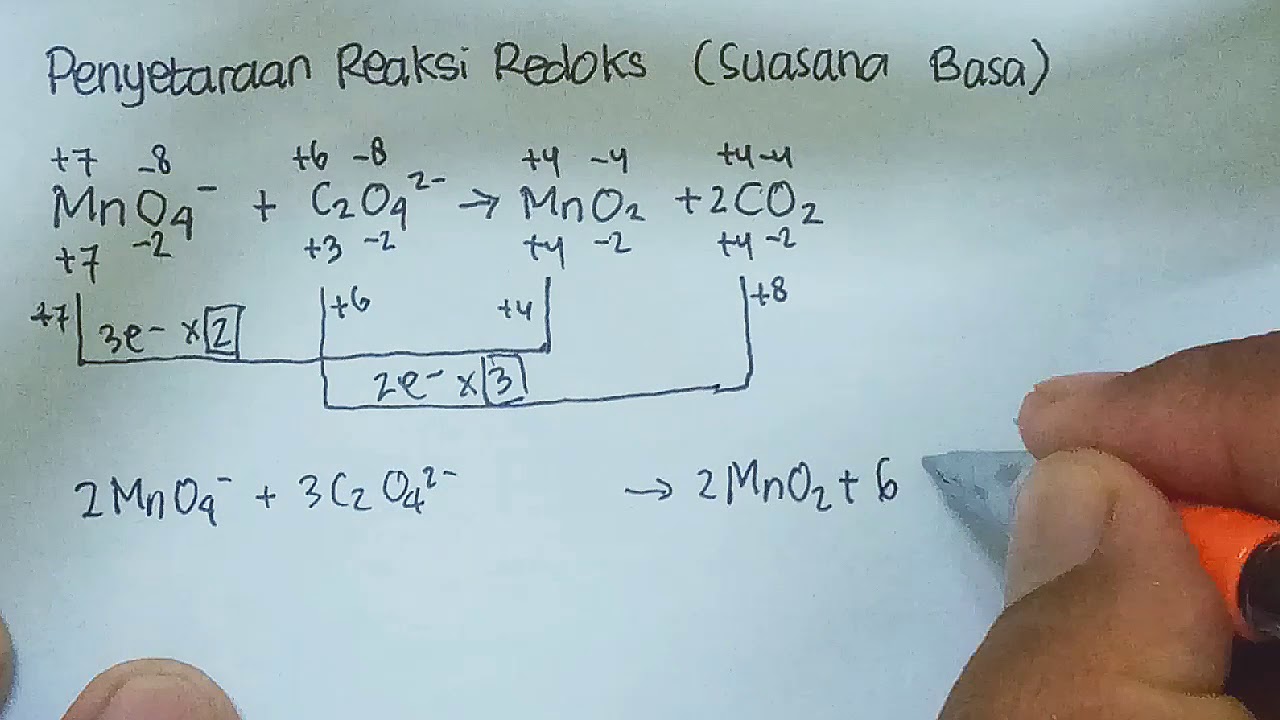
Penyetaraan MnO4-+ C2O42- → MnO2 + CO2 (suasana basa)menggunakan metode perubahan bilangan oksidasi (PBO).Hasil reaksi setara:2MnO4- + 3C2O42- + 4H2O → 2MnO2.

Cara Cepat Menyetarakan Reaksi Redoks (Metode Bilangan Oksidasi) YouTube
nilai bilangan oksidasi unsur dalam senyawa ataupun ion poliatom. Hasil pembelajaran berguna untuk membantu mempercepat penyelesaian penyetaraan persamaan reaksi redoks baik dengan metode bilangan oksidasi maupun metode setengah reaksi. Kata Kunci: bilangan oksidasi, ion, poliatom Abstract.

Menyetarakan Persamaan Reaksi Redoks Dengan Metode Bilangan Oksidasi (BILOKS) YouTube
Ada 8 aturan dalam menentukan bilangan oksidasi suatu unsur, di antaranya: 1. Bilangan oksidasi unsur bebas adalah 0. Unsur bebas adalah unsur yang tidak bergabung atau berikatan secara kimia dengan unsur lain. Unsur bebas terbagi menjadi dua, yaitu unsur bebas berbentuk atom, seperti C, Ca, Cu, Na, Fe, Al, Ne dan unsur bebas berbentuk molekul.

Cara mudah menentukan bilangan oksidasi dalam senyawa kimia YouTube
Sebagai gambaran, berikut ini adalah contoh penyetaraan reaksi dengan metode bilangan oksidasi. Cara II Metode Setengah Reaksi [4] Tulis setengah reaksi, reduksi dan oksidasi; Samakan jumlah atom yang mengalami perubahan biloks; Setarakan jumlah O: Menambah H 2 O pada spesi yang kekurangan atom O (suasana asam)

Penyetaraan Reaksi Redoks Metode Biloks atau Perubahan Bilangan Oksidasi Mudah Dipahami Kimia
Bilangan oksidasi adalah suatu bilangan yang menunjukkan ukuran kemampuan suatu atom untuk melepas atau menangkap elektron dalam pembentukan suatu senyawa. Nilai bilangan oksidasi menunjukkan banyaknya elektron yang dilepas atau ditangkap, sehingga bilangan oksidasi dapat bertanda positif maupun negatif.. Ada dua metode penyetaraan reaksi.
Contoh Soal Penyetaraan Reaksi Redoks Metode Bilangan Oksidasi Suasana Asam Riset
Tetapkan bilangan oksidasi -2 pada oksigen (tanpa perkecualian). Dalam hampir semua kasus, atom oksigen memiliki bilangan oksidasi -2. Ada beberapa perkecualian dalam peraturan ini: Saat oksigen berada dalam bentuk unsur (O 2 ), bilangan oksidasinya adalah 0, karena ini adalah peraturan untuk semua atom unsur.
Setarakan Reaksi Redoks Berikut Dengan Metode Bilangan Oksidasi My XXX Hot Girl
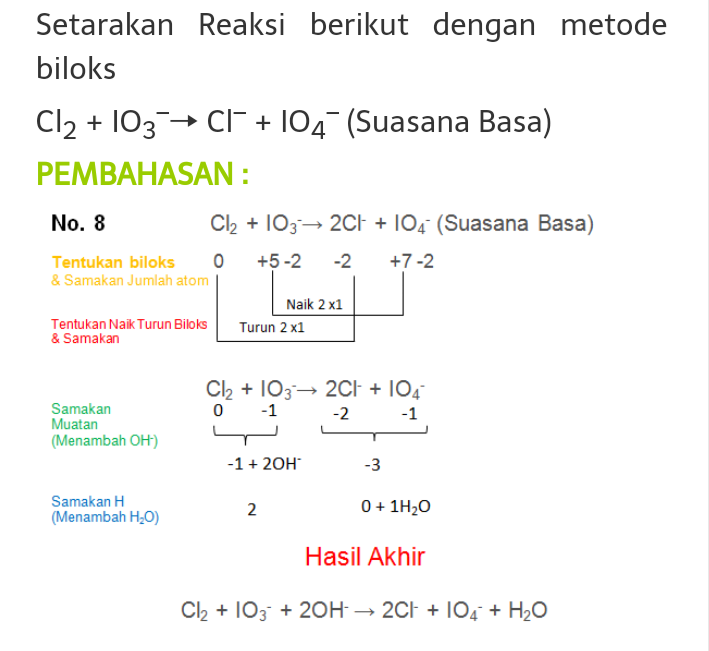
Cara II Metode Setengah Reaksi. Bagi reaksi menjadi 2, satu reduksi dan satu oksidasi; Samakan jumlah unsur yang berubah biloks. Samakan jumlah atom O dengan menambahkan H 2 O di yang kurang O sebanyak kekurangannya (Suasana asam), atau menambahkan H 2 O di yang lebih O sebanyak kelebihannya (suasana basa).; Samakan jumlah atom H dengan menambahkan H + (suasana asam) atau OH - (suasana basa).

Setarakan Reaksi Redoks Berikut Dengan Metode Bilangan Oksidasi
Metode bilangan oksidasi adalah cara yang lumayan simpel untuk menentukan bilangan oksidasi tiap unsur dalam suatu senyawa atau zat. Bilangan oksidasi sendiri adalah 'nomor' atau angka yang menunjukkan apakah suatu unsur kehilangan elektron (oksidasi) atau menerimanya (reduksi). Dengan mengetahui bilangan oksidasi, kita bisa setarakan.

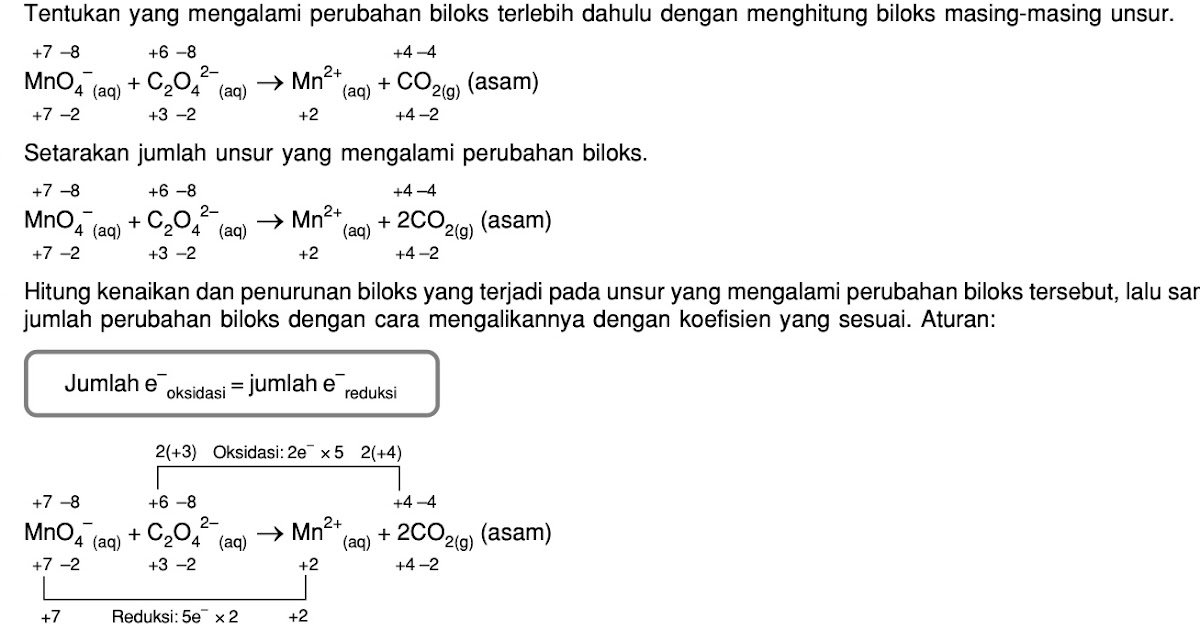
Penyetaraan reaksi redoks MnO4 dan SO3 2 dalam suasana asam dengan metode bilangan oksidasi
Metode Bilangan Oksidasi. Elo cermati mana aja unsur yang mengalami perubahan biloks, hitung biloks setiap elemen, lalu hitung kenaikan atau penurunan biloks per unsurnya. Beri label mana aja unsur yang merupakan reduktor dan oksidator. Samakan jumlah kenaikan dan penurunan biloks. Kalau udah sama, udah elo nggak usah apa-apain lagi.

Setarakan Reaksi Redoks Berikut Dengan Metode Bilangan Oksidasi
Penyetaraan reaksi ion: BiO3- + VO+ → Bi2O3 + VO2+ (suasana basa) menggunakan metode perubahan bilangan oksidasi (PBO).Reaksi setara: 2BiO3- + 2VO+ + H2O → B.

PENYETARAAN REAKSI REDOKS DENGAN METODE BILANGAN OKSIDASI YouTube
Bilangan oksidasi Fe pada FeO adalah +2 sedangkan pada Fe 2 O 3 adalah +3, karena terjadi penambahan bilangan oksidasi dari +2 menjadi +3 maka reaksi tersebut merupakan reaksi oksidasi. FeO bertindak sebagai reduktor, dan hasil oksidasinya adalah Fe 2 O 3. Baca juga: Mengenal Ikatan Hidrogen.

setarakan reaksi redoks berikut dengan metode bilangan oksidasi mno+pbo2+hno3>hmno4+pb(no3)2+h2o
Oke, kita lanjut ya bahasannya! Pada reaksi redoks, terdapat unsur-unsur yang bertindak sebagai reduktor dan oksidator. Zat yang mengalami oksidasi itu disebut reduktor, sedangkan zat yang mengalami reduksi disebut oksidator. Coba perhatikan contoh berikut ini, ya! Reaksi: Mg(s) + 2HCl -----> MgCl2(aq) + H2(g) Karena Mg merupakan unsur bebas, jadi biloks Mg = 0.
setarakan menggunakan metode bilangan oksidasi Mn...
Penyetaraan: MnO + PbO2 → MnO4- + Pb2+ (suasana asam) menggunakan metode perubahan bilangan oksidasi (PBO).#PenyetaraanReaksi Redoks#MetodePBO#PersamaanReaks.
Setarakan Reaksi Redoks Berikut Dengan Metode Bilangan Oksidasi
1. Bilangan oksidasi unsur bebas adalah 0 (nol) 2. Bilangan oksidasi ion monoatomik sama dengan muatannya. 3. Jumlah bilangan oksidasi semua atom unsur yang terdapat dalam dalam sebuah senyawa adalah 0 (nol) 4. Bilangan oksidasi atom-atom pembentuk ion poliatomik sama dengan muatannya. 5.