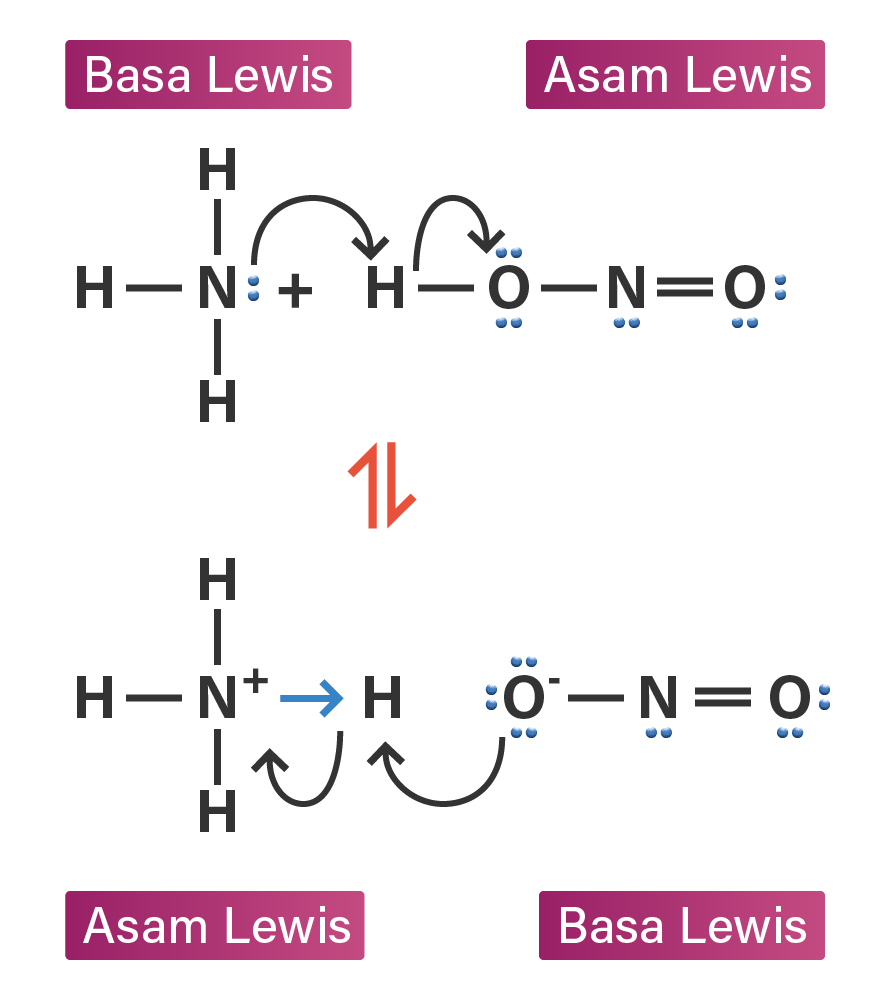
tuliskan pasangan asam basa lewis dari reaksi beri...
Menurut Lewis, asam adalah suatu senyawa yang melakukan akseptor elektron atau menerima elektron sedangkan basa adalah senyawa yang melakukan donor elektron atau memberikan elektron. Teori asam basa Lewis ini lebih spesifik dari teori sebelumnya yang hanya mendefinisikan keberadaan ion H + dan ion OH - .

XI.6.q. Teori Asam Basa Lewis (Teori) YouTube
Mulai dari pengertian, teori menurut para ahli, ciri-ciri, hingga contohnya. Jadi, untuk kamu yang sedang mencari informasi lengkap tentang asam & basa, simak artikel ini hingga habis, ya!. Asam menurut Lewis adalah zat yang punya kecenderungan menerima pasangan elektron basa, sedangkan basa adalah zat yang memberikan pasangan elektron.

Asam Basa Teori, Contoh, dan Sifat Asam Basa InformasainsEdu
Penjelasan Lengkap: jelaskan pengertian asam basa menurut arrhenius bronsted lowry dan lewis 1. Svante Arrhenius mengembangkan teori Asam Basa Arrhenius pada tahun 1887 yang menyatakan bahwa asam adalah senyawa yang menghasilkan ion hidrogen (H+) saat larut dalam air, sedangkan basa adalah senyawa yang menghasilkan ion hidroksida (OH-) saat larut dalam air.
Teori Asam Basa Lewis KIMIA OKE PINTAR
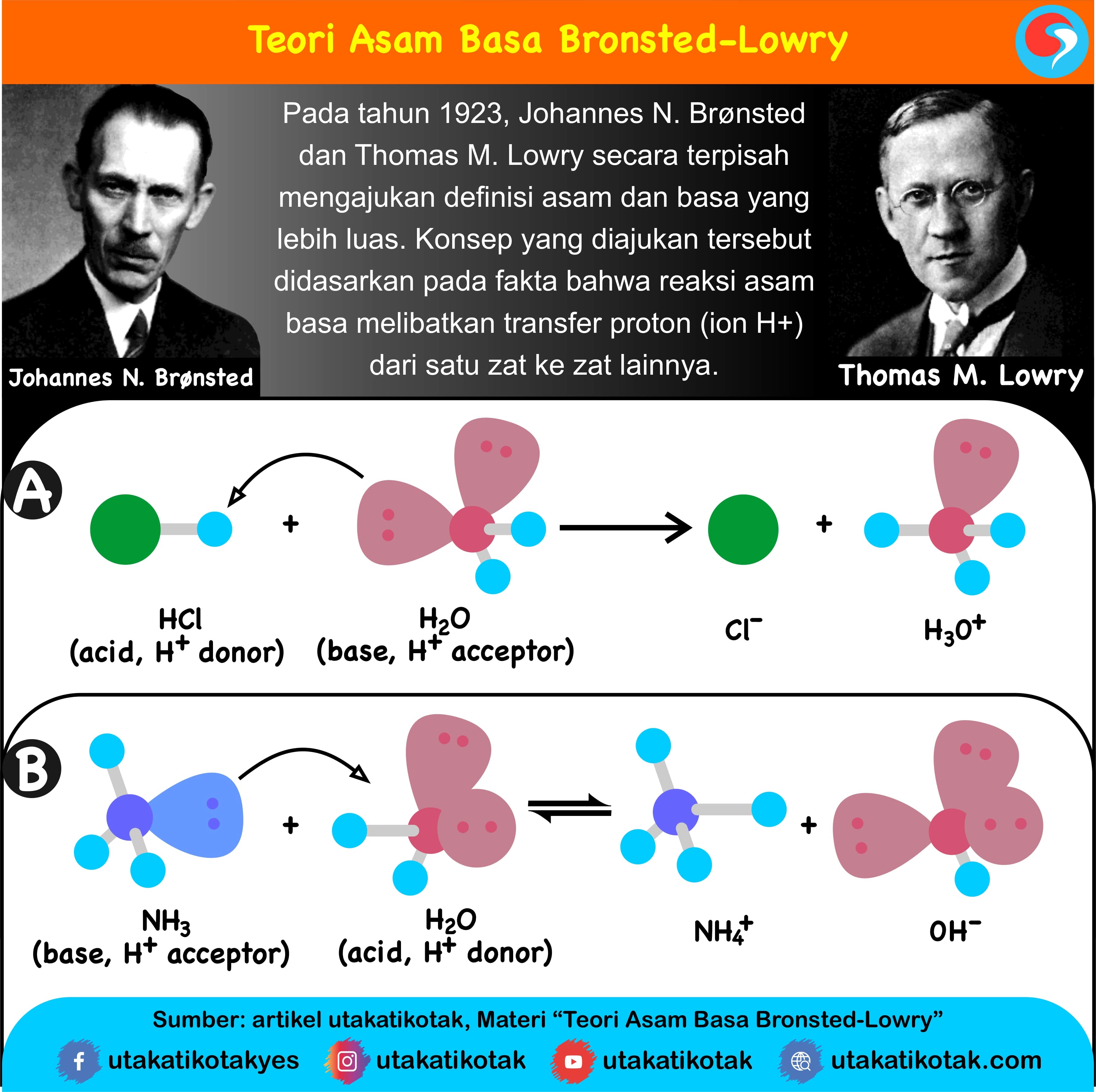
Teori Asam Basa Bronsted-Lowry. Johannes Nicolaus Bronsted dan Thomas Martin Lowry pada tahun 1923 mengembangkan teori Arrhenius dengan nama teori asam basa Bronsted-Lowry. Dalam teorinya, Bronsted dan Lowry menjawab kekuranngan yang ada dalam teori Arrhenius yang tidak dapat menyimpulkan senyawa asam basa yang reaksinya tidak membentuk larutan.

Pengertian Larutan Asam Basa, Contoh serta Indikator Asam Basa PerpusPedia
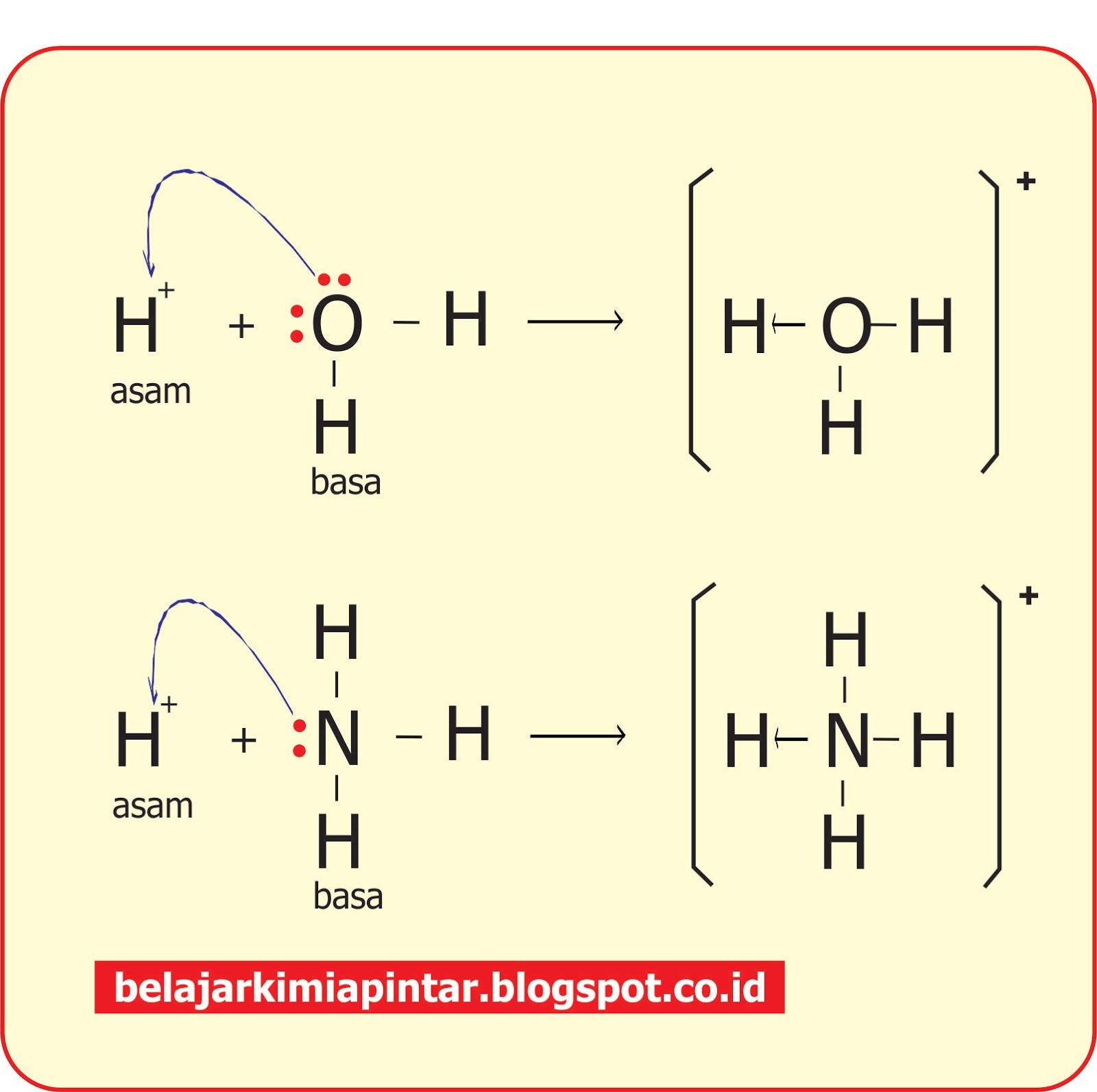
Karena Pengertian Asam Menurut Ilmu Kimia memiliki artian sebuah Senyawa Kimia (Zat) yang dapat dilarutkan didalam Air dan akan menghasilkan Laruhan dengan pH yang lebih kecil dari 7 dan yang dapat memberikan Proton (ion H+) kepada Zat lain atau Senyawa Lain yang disebut dengan Basa.. Contoh Teori Asam dan Basa Menurut Lewis pada Gambar.
PPT ASAM DAN BASA PowerPoint Presentation, free download ID4714427
Pengertian Asam Basa Lewis. Asam Lewis adalah spesies yang dapat menerima elektron, sedangkan basa Lewis adalah spesies yang dapat memberikan elektron.. Oleh karena itu keduanya bereaksi menurut reaksi netralisasi Lewis sebagai berikut: [BrF 2][SbF 6] (BrF 3) + Ag[BrF 4] Ag[SbF 6] (BrF 3) + 2 BrF 3 (l)

studying chemistry belajar kimia Teori Asam Basa Lewis
Kelebihan asam basa Lewis. Teori asam basa Lewis memiliki kelebihan sebagai berikut: 1. Memiliki persamaan dengan teori Bronsted dan Lowry, yaitu dapat menjelaskan sifat asam, basa dalam pelarut lain maupun tidak mempunyai pelarut. 2. Teori asam basa Lewis mampu menjelaskan sifat asam basa molekul atau ion yang mempunyai pasangan elektron bebas.

Contoh Soal Asam Basa Lewis Asam Basa Pengertian Teori Reaksi Indikatornya Lengkap Contoh
Beberapa ciri khas dari reaksi asam dan basa menurut Lewis antara lain: - Asam dan basa dapat berupa senyawa yang tidak larut dalam air, sehingga reaksi asam dan basa menurut Lewis tidak terbatas pada larutan air saja. - Reaksi asam dan basa menurut Lewis dapat terjadi tanpa adanya ion H+ (hidrogen) atau ion OH- (hidroksil) dalam reaksi.
Pengertian Asam dan Basa Menurut BronstedLowr
Teori Asam Basa Menurut Lewis. Materi Asam-Basa: Pengertian, Ciri-Ciri, Contoh, & Rangkuman. Pengertian Asam, Basa, dan Garam: Ciri, Contoh, dan Rangkuman. Teori Asam Basa Menurut Para Ahli Serta Indikator Alami dan Buatan. Populer Jokowi Tunjuk Ma'ruf Amin jadi Plt Presiden hingga 6 Maret 2024.

Spesi berikut yang berperan sebagai asam Lewis adalah.
Salah satu pengertian asam yang dapat digunakan sebagai dasar pemahaman adalah menurut konsep asam menurut Lewis. Gagasan ini diperkenalkan oleh ilmuwan Gilbert N. Lewis pada tahun 1923. Konsep asam menurut Lewis memberikan sudut pandang yang berbeda tentang sifat-sifat asam dan dapat membantu dalam memahami interaksi kimia yang kompleks.

Pengertian Asam Basa Menurut Lewis cara menghemat air
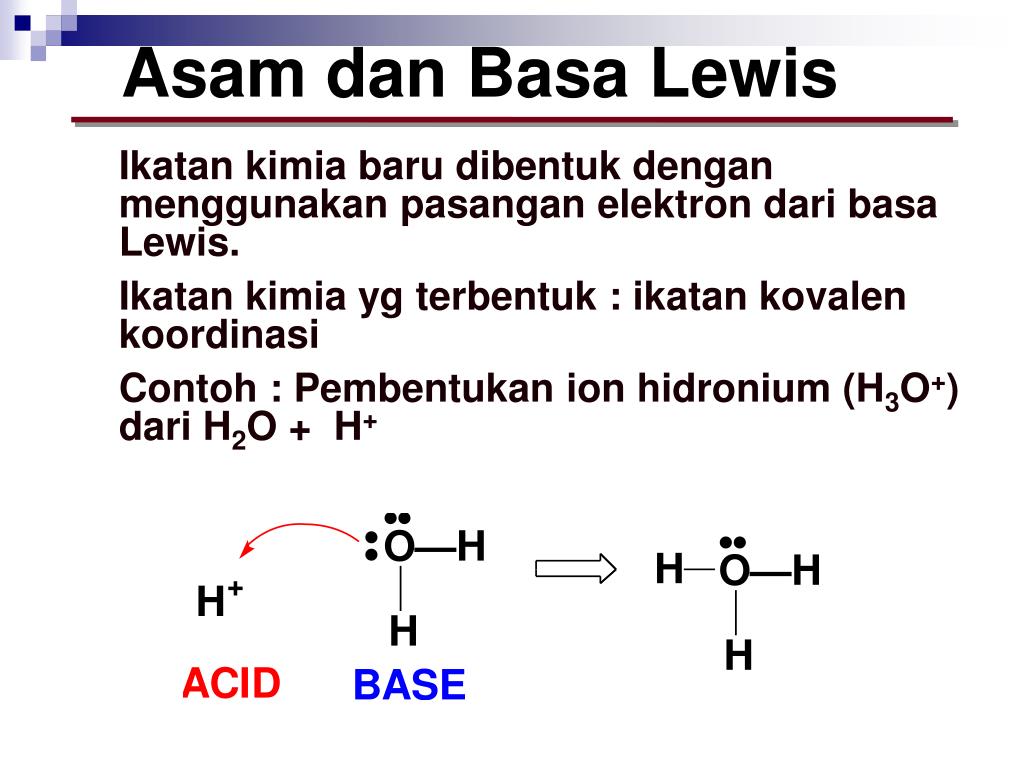
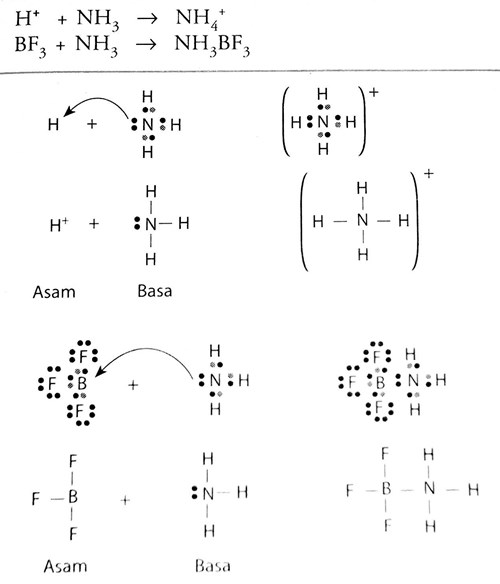
Berdasarkan teori Lewis, H 2 O adalah basa Lewis karena mendonorkan pasangan elektron kepada ion H + yang berasal dari molekul HCN membentuk ion H 3 O + sedangkan H + dari HCN adalah asam Lewis karena menerima pasangan elektron dari atom O pada H 2 O. 2. Teori Arrhenius dan teori Brønsted-Lowry tidak dapat menjelaskan reaksi ini.
Konsep Asam Basa Menurut Lewis Pengertian Dan Contohnya Jempol Kimia Riset
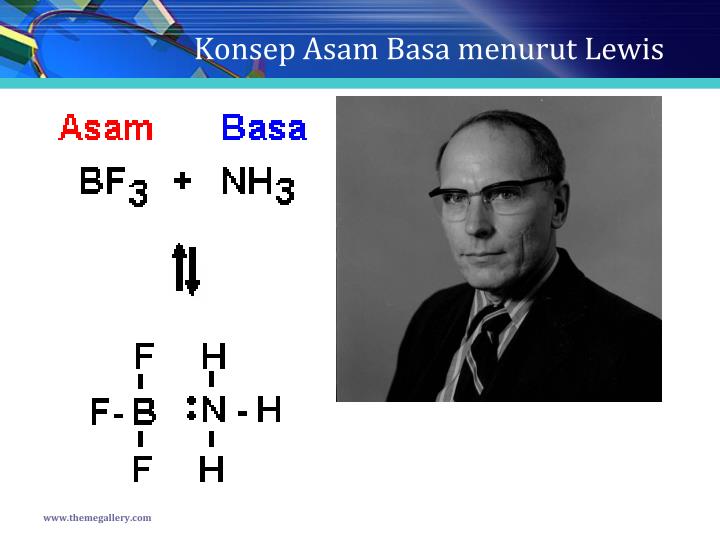
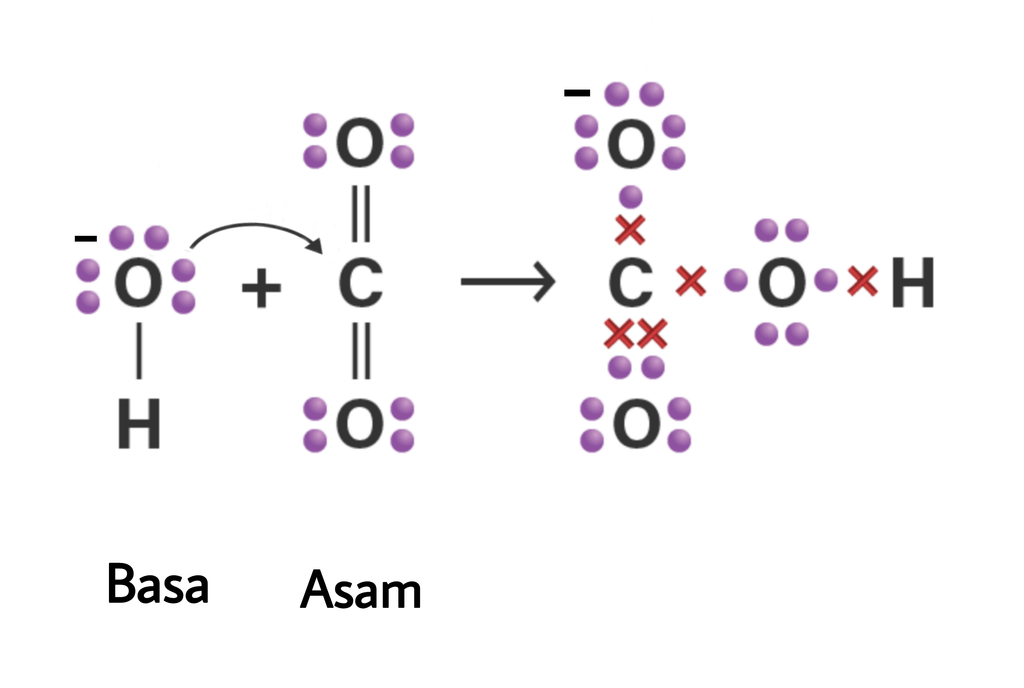
Baca juga: Teori Asam Basa: Pengertian Para Ahli dan Sifatnya. Menurut teori asam basa Lewis, asam adalah zat yang menerima pasangan elektron. Sedangkan basa adalah zat yang menyumbangkan atau mendonasikan pasangan elektron. Di mana transpor elektron tersebut membuat asam dan basa bereaksi, sehingga menghasilkan ikatan kovalen koordinat.
Teori AsamBasa Lewis
Contoh dari beberapa asam Lewis adalah SO3, BF3, maupun AlF3. Sedangkan basa menurut Newton Lewis merupakan zat yang mampu memberikan pasangan pada electron. Dalam pandangan teori asam basa Lewis, basa memiliki pasangan yang elektronnya bebas, contohnya adalah seperti NH3, Cl-, maupuan ROH.

Struktur Lewis Asam Sulfat H2SO4 dan Cara Menggambarnya
Oleh karena itu, pada tahun 1932, Gilbert N. Lewis, seorang kimiawan asal Amerika Serikat mengemukakan teori asam basa yang lebih luas dibandingkan dua teori sebelumnya yang kemudian dikenal dengan teori asam basa Lewis. Menurut Lewis, asam basa adalah reaksi yang berkaitan dengan proses serah terima (transfer) elektron.

LENGKAP ‼️ Teori Asam Basa Lewis Latihan Soal dan Pembahasan YouTube
Lewis: Menurut definisi ini, asam adalah penerima pasangan elektron dari basa. Definisi yang dikemukakan oleh Gilbert N. Lewis ini dapat mencakup asam yang tak mengandung hidrogen atau proton yang dapat dipindahkan, seperti besi(III) klorida. Definisi Lewis dapat pula dijelaskan dengan teori orbital molekul.
Berdasarkan teori asam basa Lewis, manakah spesi y...
Pengertian Asam Basa Menurut Lewis - Konsep asam basa merupakan salah satu konsep dalam kimia yang sangat penting. Konsep ini membantu kita memahami bagaimana suatu zat dapat bereaksi dalam larutan, dan memberikan pemahaman yang mendalam tentang sifat-sifat asam dan basa. Salah satu tokoh yang memberikan kontribusi besar dalam pengembangan.