
laju reaksi(Orde reaksi, rumus laju reaksi dan k) Kimia sma YouTube
Apabila terdapat reaksi: pA + qB → rC Laju reaksinya dirumuskan sebagai berikut. Dengan: r = laju reaksi (mol.dm-3.det-1) k = tetapan laju reaksi x = tingkat reaksi (orde reaksi) terhadap A y = tingkat reaksi (orde reaksi) terhadap B [A] = konsentrasi awal A (mol.dm-3) [B] = konsentrasi awal B (mol.dm-3) Tingkat reaksi total adalah jumlah.

Rumus Laju Reaksi dan orde reaksi Kimia SMA YouTube
4. Harga tetapan laju reaksi. Konstanta laju reaksi atau tetapan laju reaksi adalah tetapan yang harganya bergantung pada jenis pereaksi, suhu dan katalis. Tetapan laju reaksi berbanding terbalik dengan perubahan waktu. Semakin cepat reaksi berlangsung, maka harga tetapan laju reaksi semakin besar. Dan berbanding lurus dengan perubahan suhu.

Contoh Soal Laju Reaksi YouTube
Laju reaksi adalah perubahan konsentrasi reaktan atau produk per satuan waktu. Besaran laju reaksi dilihat dari ukuran cepat lambatnya suatu reaksi kimia. Laju reaksi mempunyai satuan M/s (Molar per detik ). [1] Laju reaksi dilambangkan dengan v atau r. Laju reaksi atau kecepatan reaksi menyatakan bahwa banyaknya reaksi kimia yang berlangsung.
Laju Reaksi dan FaktorFaktor yang Memengaruhinya Kimia Kelas 11
Laju Reaksi: Pengertian, Rumus, Contoh, Soal. Februari 12, 2024 Oleh Eka, S.Si. Banyak reaksi yang terjadi di sekitar kita dengan kecepatan (laju reaksi) yang berbeda-beda. Laju reaksi yang dimaksud di sini adalah laju berkurangnya jumlah reaktan atau laju bertambahnya jumlah produk dalam satuan waktu.

Laju Reaksi Kimia Mengenal Pengertian, Rumus, dan Faktor yang mempengaruhinya Study Education2
Pengertian Laju Reaksi. Laju reaksi adalah perubahan konsentrasi dari reaktan ataupun produk per satu satuan waktu. Untuk reaksi dengan reaktan A dan B menghasilkan produk C dan D seperti pada rumus persamaan reaksi berikut, seiring waktu jumlah molekul reaktan A dan B akan berkurang dan jumlah molekul produk C dan D akan bertambah, dan rumus laju reaksi (v) yaitu:

Pengertian dan Teori Laju Reaksi Materi Kimia Kelas 11
Tuliskan rumusan tetapan kesetimbangan pembentukan amoniak dari gas hidrogen dan gas nitrogen berikut. 3H2(g) + N2(g) ⇌ 2NH3(g) Hitung tetapan kesetimbangan pada soal nomor 2, jika dalam keadaan setimbang (suhu 300°C) 1 Liter campuran gas mengandung 0,15 mol gas hidrogen; 0,25 mol gas nitrogen; dan 0,1 mol gas amoniak.

Persamaan Laju Reaksi Penjelasan, Rumus, Contoh Soal dan Jawaban
Oleh karena itu persamaan dari materi ini adalah sebagai berikut. Di mana, v= laju reaksi (mol/L/s); = perubahan mol; = perubahan waktu. Di mana, v= Laju reaksi (mol/L/s) ; k= konstanta laju reaksi; n= orde reaksi zat B; m= orde reaksi zat A. Secara logika, pada saat bereaksi, zat reaktan pasti makin berkurang, dan zat produk pasti bertambah bukan?

Laju Reaksi dan FaktorFaktor yang Memengaruhinya Kimia Kelas 11 Belajar Gratis di Rumah
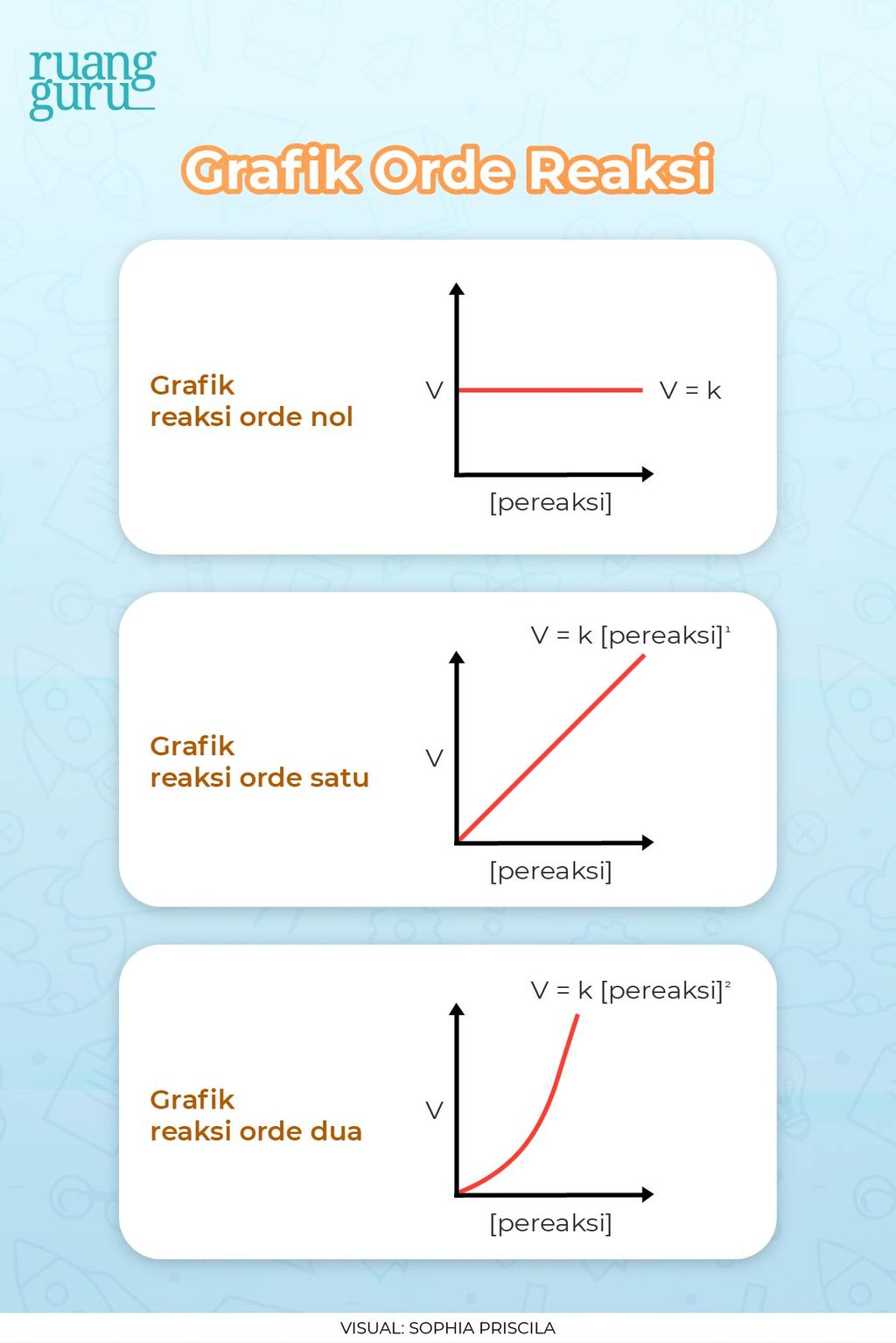
2. Orde Satu. Orde reaksi 1 atau suatu reaksi orde satu terhadap salah satu pereaksinya jika laju reaksinya berbanding lurus dengan konsentrasi pereaksi itu. Sebagai contoh bila konsentrasi pereaksi dilipat-duakan, maka laju reaksi akan menjadi kali lipatnya. Bila diplot akan terbentuk kurva berikut: 3.

Menentukan Rumusan Laju Reaksi (v) dan Tetapan Laju Reaksi (k) YouTube
Persamaan Laju Reaksi. Bila diketahui suatu reaksi: lA + mB → nC + oD. Maka persamaan lajunya dapat dinyatakan sebagai. v = k[A]x[B]y. dimana, k = tetapan jenis reaksi. x = orde (tingkat atau pangkat) reaksi terhadap pereaksi A. y = orde (tingkat atau pangkat) reaksi terhadap pereaksi B.

Cara Cepat menentukan Laju Reaksi Konsep Dasar tabel MTS YouTube
Nilai persamaan laju reaksiadalah sebagai berikut: Di mana: k = konstanta/tetapan laju reaksi x = orde/tingkat reaksi terhadap A y = orde/tingkat reaksi terhadap B x = y = orde reaksi total. Contoh Reaksi dan Rumus Laju Reaksi dari Hasil Eksperimen. Berikut ini terdapat beberapa contoh reaksi dan rumus laju reaksi yang diperoleh dari hasil.

laju reaksi, rumus laju reaksi, orde laju reaksi UN kimia 2016 pembahasan 23 YouTube
Contoh Soal 2. Gas SO 3 terurai sempurna menjadi SO 2 dan O 2 di dalam suatu bejana yang volumenya 8 liter. Reaksi penguraian tersebut berlangsung selama 16 menit. Jika mol awal SO 3 64 mol, maka laju penguraian SO 3 nya adalah. 0,2 M/menit. 0,5 M/menit. 0,01 M/menit. 2 M/menit. 5 M/menit.

Pengertian Laju Reaksi, Rumus, Hukum, Faktor Pengaruh, dan Contohnya Ilmu Kimia
Contoh beberapa reaksi dan rumus laju reaksinya. Persamaan Laju Reaksi dan Orde Reaksi - Contoh Soal dan Jawaban. Ilustrasi dan sumber foto: PINTERpandai.com [Royalty Free] Beberapa hal yang harus dipahami terlebih dahulu sebelum menentukan persamaan laju reaksi adalah sebagai berikut: Tetapan laju reaksi (k) bergantung pada jenis reaksi dan.

CARA MENENTUKAN ORDE REAKSI DAN PERSAMAAN LAJU REAKSI DARI TABEL PERCOBAAN YouTube
Faktor yang Memengaruhi Laju Reaksi. Laju reaksi bisa dipengaruhi oleh beberapa faktor, lho! Faktor-faktor tersebut dapat mempercepat laju reaksi atau malah memperlambat laju reaksi. Faktor-faktor tersebut antara lain suhu, konsentrasi, katalisator, dan luas permukaan sentuh. Nah, kita akan bahas beberapa saja, ya.

Contoh Soal Laju Reaksi Dan Orde Reaksi
Jakarta - . Laju reaksi adalah perubahan konsentrasi tiap perubahan waktu. Perubahan tersebut bisa bertambah atau bisa berkurang. Adapun dikutip dari Modul Pembelajaran SMA Kimia Kelas XI oleh Kemendikbud, laju reaksi menggambarkan kecepatan proses pemakaian reaktan dan pembentukan produk dalam suatu reaksi kimia.. Konsep laju reaksi kimia untuk reaksi: A → B dirumuskan seperti berikut:

Persamaan Laju Reaksi dan Orde Reaksi KIMIA KELAS 11 YouTube
Rumus Persamaan Laju Reaksi Menurut Modul terbitan Kemendikbud, konsep laju reaksi kimia untuk persamaan reaksi: A → B dirumuskan. laju reaksi dalam suatu sistem homogen pada suhu tertentu ternyata juga berbanding lurus dengan kosentrasi reaktan dan tetapan laju k, sehingga hukum laju reaksinya dapat dinyatakan sebagai berikut: X → Produk

LAJU REAKSI Cara menentukan persamaan laju reaksi jika zat yang bereaksi ada tiga YouTube
V1 V 1: laju awal. T2 T 2: suhu akhir. T1 T 1: suhu awal. ΔV Δ V: faktor laju. ΔT Δ T: faktor suhu. Sehingga bila laju reaksi awal diketahui, waktu reaksi yang dibutuhkan setelah kenaikan suhu dapat diketahui lewat perumusan berikut: tt = 1 (Δv) ΔT ΔT∘ ×t0 t t = 1 ( Δ v) Δ T Δ T ∘ × t 0. Vt = 1 tt V t = 1 t t.