Kenaikan Titik Didih Penurunan Titik Beku Sifat Koligatif Larutan Reverasite
Haiko fans pada soal ini ditanyakan kenaikan titik didih atau Delta TB larutan 5 mol sukrosa adalah di sini diketahui 0,51 derajat Celcius sukrosa merupakan zat nonelektrolit yang sama dengan 0 dengan 1 ditambah jumlah dikurang 1 dikali Alfa akan = 1 karena apanya = 0 Delta TB = molalitas dikalikan dengan molalitasnya di sini adalah 5 molal dan KB nya adalah 0,51 serta ini adalah 1 maka Delta.
Modul I Sifat Koligatif Larutan Penurunan Titik Beku Larutan Mobile
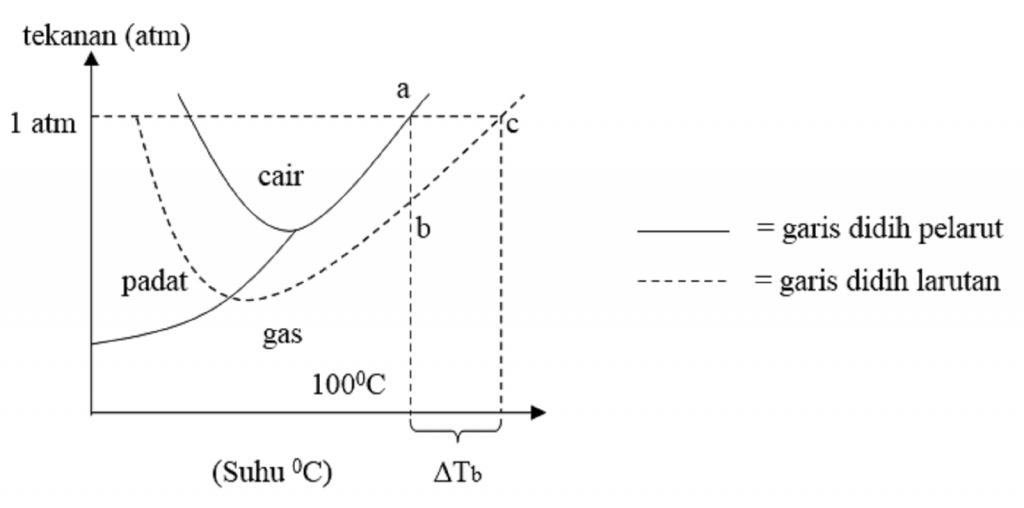
Sehingga pada temperatur 100 o C larutan sukrosa belum mendidih sebab telanannya kurang dari 760 mmHg. Larutan ini memerlukan temperatur yang lebih tinggi lagi agar tekanan uap jenuhnya sama dengan tekanan udara di sekitarnya.. Kf air = 1,86 o C/molal. Maka titik beku larutan tersebut adalah.. a. -5,208 o C. b. -4,208 o C. c. -3,208 o C.

Berikut disajikan data percobaan tentang titik beku beber...
Ada 8 gram zat A dilarutkan kedalam 200 ml air. Jika diketahui tetapan penurunan titik beku air (Kf) air 1,86 °C/m dan massa molar zat tersebut adalah 40 gr/mol, hitung titik beku larutan! Jawaban: ΔTf = (gr zat terlarut / Mr) x (1000 / g pelarut) x Kf. ΔTf = (8 / 40) x (1000 / 200) x 1.86. ΔTf = 0.2 x 5 x 1.86 = 1.86°C.

Contoh Soal Penurunan Titik Beku Larutan Dikdasmen
100, 0128 ∘ C. 5. 100, 0234 ∘ C. Belajar Modul, Rumus, & Soal Sifat Koligatif Larutan dan kuis interaktif. Dapatkan Modul, Rumus, & Soal Sifat Koligatif Larutan lengkap di Wardaya College.

Contoh Soal Titik Beku Larutan (Sifat Koligatif Larutan Elektrolit) YouTube
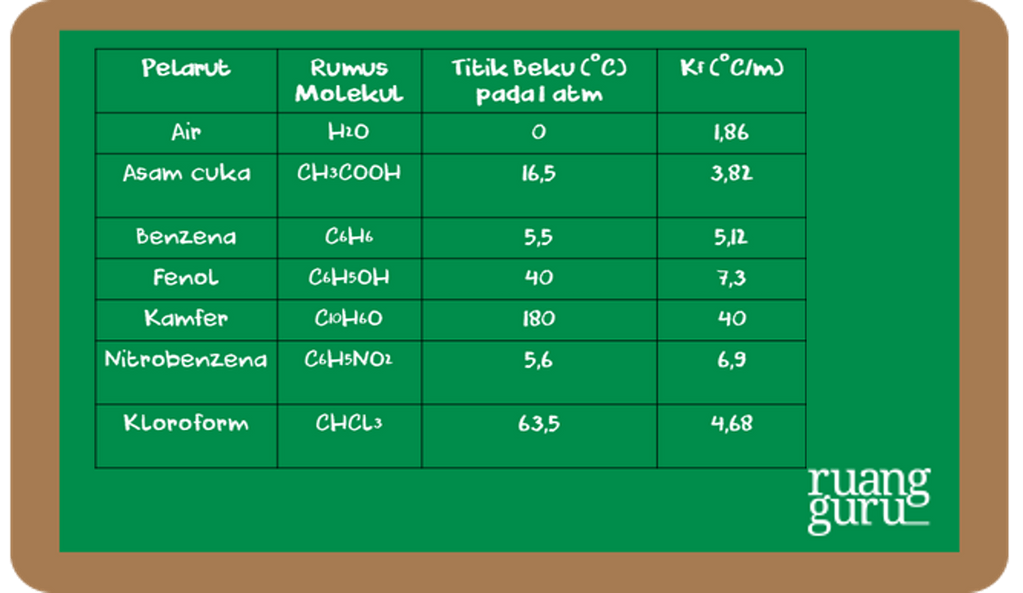
K f = tetapan penurunan titik beku molal (℃ m-1) m = molalitas larutan (m) Beberapa pelarut ada yang sudah ditentukan harga tetapan penurunan titik bekunya (K f). Berikut daftar pelarutnya.. Hitunglah titik beku larutan etilen glikol 25,0% (berdasarkan massa) dalam air! ((K f = 5,38 °C/m Ar C = 12, O = 16, H = 1)
Mengetahui Proses Penurunan Titik Beku Kimia Kelas 12
Contoh soal dan pembahasan. Contoh soal 1. Sebanyak 2,4 gram urea (Mr = 60) dilarutkan dalam 50 gram air. Jika Kf air = 1,86 °C/m, tentukanlah titik beku larutan. Pembahasan. Pada soal ini urea sebagai zat terlarut dan air sebagai pelarut. Besaran yang diketahui sebagai berikut: gr = 2,4 gram. Mr = 60.
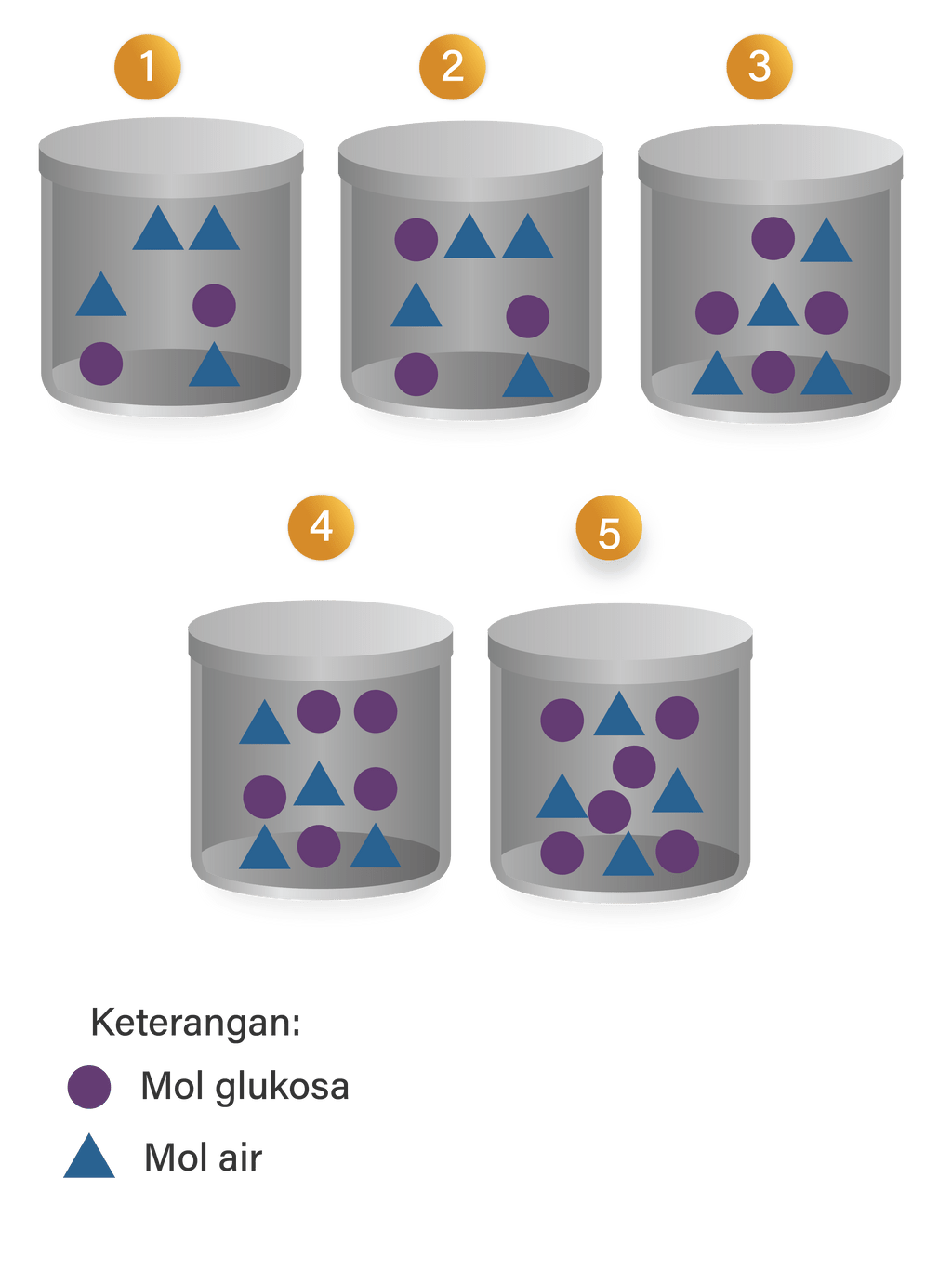
Perhatikan bagan berikut Larutan yang mem...
Titik didih dan titik beku larutan glukosa sebagai berikut: Menentukan molalitas. m = Mr glukosamassa glukosa × massa pelarut1000 m = 180 g/mol18 g × 10 gram1000 m = 10 molal. Menentukan kenaikan titik didih larutan. Tb = m× Kb Tb = 10 m ×0,52 ∘C/m Tb = 5,2 ∘C.

Tekanan Uap Larutan Sukrosa YouTube
Titik beku larutan sukrosa 5 molal dalam air adalah -2 C. Menurut perkiraan, larutan NaCl 2 molal akan membeku pada suhu. Beri Rating · 0.0 (0) Balas. Yah, akses pembahasan gratismu habis. Tonton iklan Tonton iklan Akses jawaban tanpa iklan. atau. Dapatkan jawaban pertanyaanmu di AiRIS..

Penurunan Titik Beku Larutan Dan Contoh Soal Faktasantuy Com My XXX Hot Girl
Untuk larutan elektrolit menggunakan rumus: Keterangan: ∆T f = Penurunan titik beku. K f = Tetapan penurunan titik beku molal. n = Jumlah mol zat terlarut. p = Massa pelarut. i = Faktor Van't Hoff. Dalam bidang thermodinamika konstanta titik beku ( K f ) lebih dikenal dengan istilah "Konstanta Kriokopik".

Firstwisnu Media Kenaikan Titik Didih Dan Penurunan Titik Beku Larutan Reverasite
titik beku larutan sukrosa 5 molal dalam air adalah -2 derajat celcius. menurut perkiraan, larutan Nacl 2 molal akan membeku pada suhu

Menentukan Rumus Molekul Senyawa dari Penurunan Titik Beku YouTube
Halo Google jadi kali ini kita akan membahas soal terkait dengan sifat koligatif larutan pada soal ini dikatakan bahwa titik beku larutan sukrosa 5 molal dalam air adalah sebesar minus 2 derajat Celcius menurut perkiraan Larutan natrium klorida 2 molal akan membeku pada suhu derajat di dari soal ini kita telah mengetahui titik beku larutan dari sukrosa yaitu minus 2 derajat Celcius kemudian.
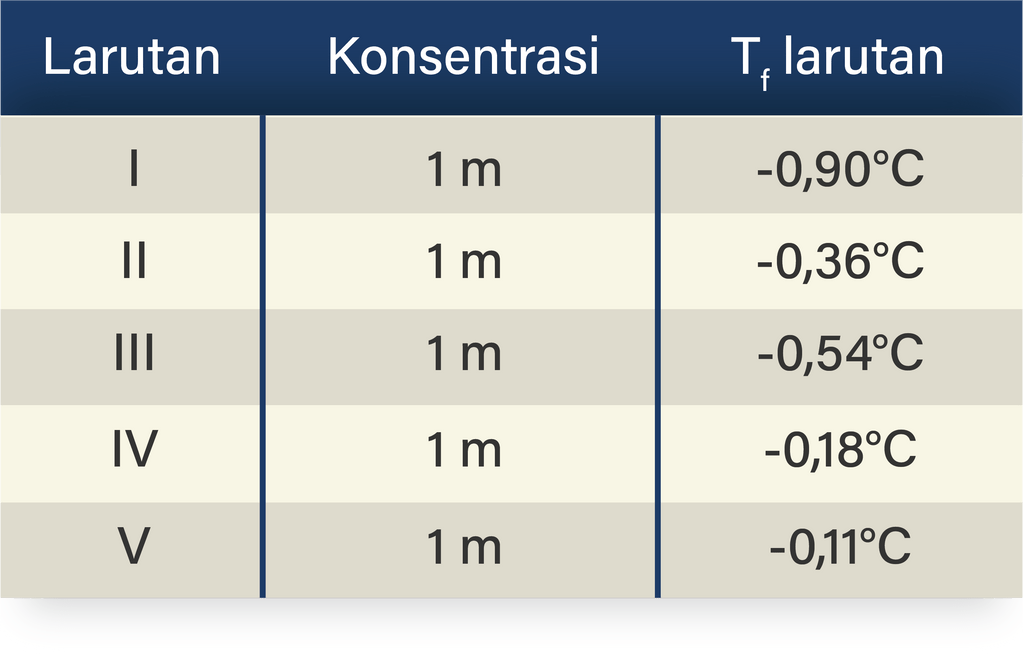
Berikut ini data titik beku beberapa larutan dalam...
Contoh soal sifat koligatif larutan nomor 8. Fraksi mol urea dalam air adalah 0,2. Tekanan uap jenuh air murni pada suhu 20 o C sebesar 17,5 mmHg. Maka tekanan uap jenuh larutan pada suhu itu adalah. mmHg. A. 3,4 B. 14 C. 17,5 D. 17,7 E. 21. Pembahasan. Fraksi mol pelarut (x A) = 1 - 0,2 = 0,8 P A = x A. P 0 P A = 0,8 . 17,5 mmHg = 14 mmHg.

Penurunan Titik Beku Catatan Pak Rizal
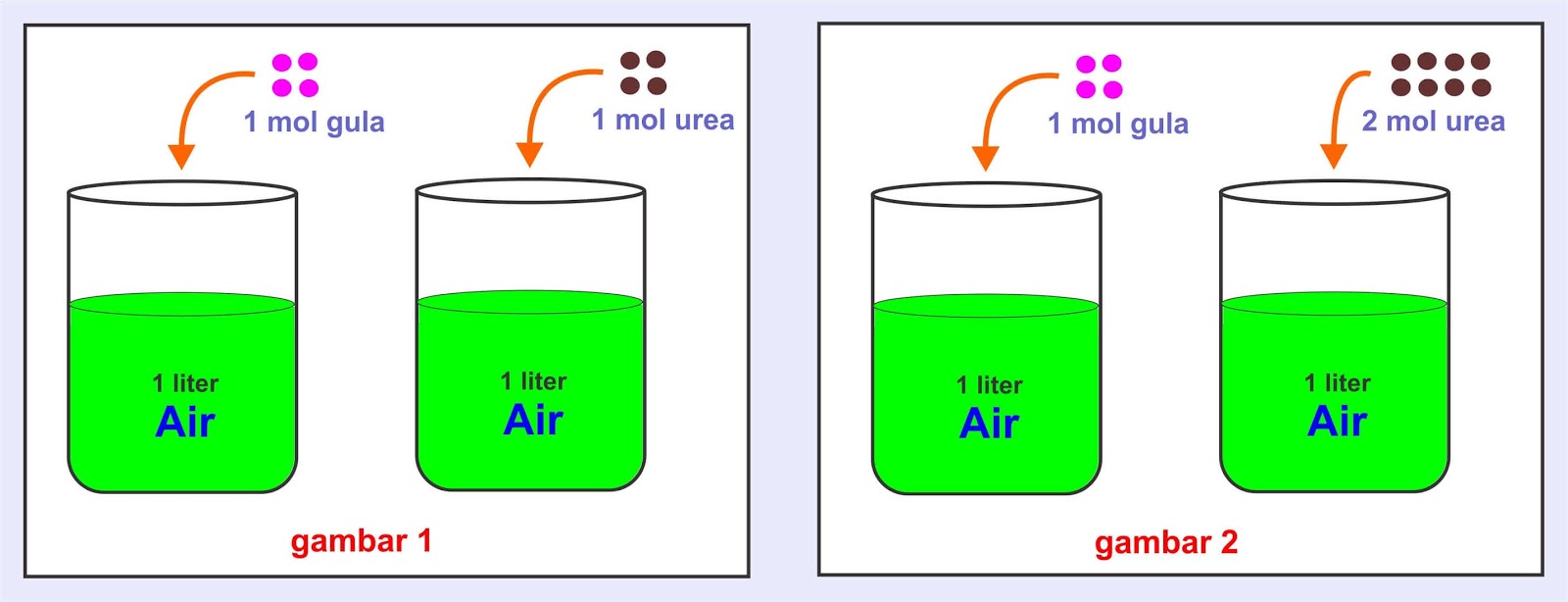
Kenaikan titik didih larutan 5 molal sukrosa adalah.. (Kb air = 0,51 o C) a. 51 o C. b. 53 o C. c. 55 o C. d. 57 o C. e. 59 o C. 27. Multiple Choice. Edit.. maka besarnya penurunan titik beku larutan ditentukan oleh.. a. Jenis zat terlarut. b. Jumlah partikel zat terlarut. c. Jenis larutan. d. Jenis pelarut. e. Perbedaan titik beku.

Penurunan titik beku larutan PDF
Titik beku larutan sukrosa 5 molal mengacu pada suhu di mana larutan sukrosa 5 molal mulai membeku. Larutan sukrosa 5 molal adalah larutan yang dibuat dengan mencampurkan 5 mol gula (sukrosa) ke dalam 1 kilogram air. Dalam hal ini, titik beku untuk larutan sukrosa 5 molal adalah pada suhu tertentu di mana air mulai membeku dan menghasilkan.

Data percobaan penurunan titik beku Larutan Konsentrasi
titik beku larutan sukrosa 5 molal dalam air -2°C,. MA. M A. 09 September 2019 14:22. Pertanyaan. titik beku larutan sukrosa 5 molal dalam air -2°C, menurut perkiraan larutan NaCl 2 molal akan membeku pada suhu 89. 1. Iklan. Iklan. PK. Petrus K. 16 Maret 2023 13:17.

Larutan yang memiliki titik beku paling rendah adalah.
Gula: Konsentrasi (molal): 0,10 & 0,01 | Titik beku: -0,1860 & -0,0186 Berdasarkan data percobaan di atas, maka besarnya penurunan titik beku larutan ditentukan oleh.. A. Jenis zat terlarut B. Jumlah partikel zat terlarut C. Jenis larutan. E. Sukrosa (Mr = 342) Jawaban: E 7. Berikut ini peristiwa kimia dalam kehidupan sehari-hari :